
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

早发性子痫前期(EOPE)与过度凋亡和炎症有关,但这些过程之间的机制联系仍是谜团。本研究报告 EOPE 患者早期孕期循环促凋亡蛋白升高,同时 EOPE 胎盘 CASP3 活化和 GSDME 切割。利用多种滋养层细胞系,我们证明了高度表达 GSDME 的滋养层细胞从凋亡转变为依赖 CASP3 的焦凋亡,从而驱动炎症。值得注意的是,热芽滋养层细胞进一步诱导胎盘绒毛类器官内的促炎巨噬细胞极化,建立一个反馈回路,增强滋养层细胞热剥作用和滋养层细胞-巨噬细胞组合中的炎症反应。在体内,CASP3-GSDME 介导的滋养层细胞热剥蚀在野生型孕妇小鼠中会引起全身性炎症,但在 Gsdme −/−小鼠中则无此影响。对 EOPE 预防药物的筛选显示,维生素 D 是滋养层细胞中 GSDME 活化和热剥作用的抑制因子。我们的共同研究结果确立了 CASP3–GSDME 介导的缓慢性减少作为 EOPE 中细胞凋亡与炎症之间的机制性联系。

在早期子痫前期(EOPE)的复杂病理机制中,凋亡与炎症之间的联系一直未能得到明确阐明。近日,一项研究通过对临床样本、多种滋养细胞模型以及动物实验的系统分析,揭示了CASP3/GSDME介导的滋养细胞焦亡及其与巨噬细胞极化之间的相互作用,是驱动EOPE胎盘及全身炎症的关键分子环路。
研究团队首先在EOPE患者的胎盘组织中发现,CASP3的活化与GSDME的裂解水平显著升高。进一步分析早孕期(孕12-16周)血浆蛋白质组学数据,发现凋亡相关蛋白BAX、CASP3等在后来发展为EOPE的孕妇中已提前升高,提示过度凋亡是EOPE发病的早期事件。
为了验证过度凋亡如何触发炎症,研究在多种滋养细胞系及原代滋养细胞中采用凋亡诱导剂(TNFα与SM164联用)进行干预。结果发现,当凋亡信号持续增强时,本应走向凋亡的滋养细胞,其死亡模式发生了关键转变:活化的CASP3对GSDME进行切割,导致细胞转向焦亡。焦亡细胞表现出典型的肿胀、膜破裂形态,并释放LDH、损伤相关分子模式蛋白HMGB1以及促炎细胞因子IL-1β和IL-18。这一过程在敲低GSDME或被CASP3抑制剂Z-DEVD-FMK阻断后显著减弱,证实了CASP3/GSDME轴的核心地位。
更重要的是,研究构建了高度模拟体内微环境的胎盘绒毛类器官模型。当类器官中的滋养细胞发生焦亡时,其释放的炎性因子会驱动共培养的巨噬细胞向促炎表型极化,表现为iNOS表达升高而CD163表达降低。反之,这些被极化的促炎巨噬细胞又能进一步加剧滋养细胞的焦亡,从而在胎盘局部形成一个自我放大的炎症正反馈环路。
体内实验为此机制提供了有力佐证。在孕早期小鼠中注射TNFα与SM164,可成功模拟出胎盘滋养细胞CASP3/GSDME通路的活化、巨噬细胞的促炎极化以及血清IL-1β和IL-18水平的系统性升高。而在GSDME基因敲除小鼠中,尽管CASP3仍被激活,但胎盘巨噬细胞的表型转换和全身炎症反应均被显著抑制,明确了GSDME介导的胎盘局部焦亡是引发全身炎症的关键环节。
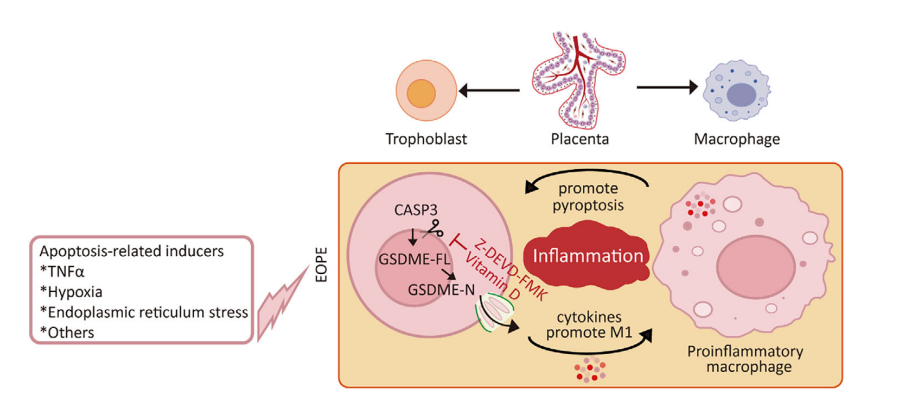
基于上述机制,研究团队对几种潜在的子痫前期预防药物进行了筛选。值得注意的是,维生素D预处理能有效抑制T/S诱导的GSDME裂解和焦亡表型,而GLP-1类似物、阿司匹林和二甲双胍在此模型中未显示出同等效果。这提示对于存在CASP3/GSDME通路过度活化的EOPE高危人群,维生素D可能是一种具有潜力的靶向干预策略。
这项研究系统性地阐明了EOPE中连接凋亡与炎症的缺失环节:过度凋亡信号通过激活CASP3,切割滋养细胞高表达的GSDME,将细胞死亡模式切换为焦亡;焦亡释放的炎性介质驱动胎盘巨噬细胞向促炎表型极化,而极化后的巨噬细胞又反向加剧滋养细胞焦亡,形成恶性循环,最终导致局部及全身炎症失控。该发现不仅深化了对EOPE发病机理的理解,也为开发以CASP3/GSDME通路为靶点的新型预防与治疗策略提供了重要的理论依据。未来,针对特定生物标志物人群的大规模临床试验,将有助于验证维生素D等干预手段的临床转化价值。
参考文献:
DOI: 10.1002/advs.202516948
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫