
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

纳米药物难以有效穿透肿瘤核心并实现对肿瘤干细胞的有效杀伤,是导致肿瘤复发、转移和耐药的重要因素。基于肿瘤微环境的策略为应对与深度肿瘤治疗相关的挑战提供了新的视角和方法。在这里,我们通过将碱性 L-精氨酸整合到 MgF2 中来设计新型 MgF2@L-Arg 纳米颗粒 (ML NPs)。在肿瘤内的内源性酸梯度下,ML NPs 选择性地质子化其近端胺,导致空间电荷不对称。这促进了 ML NPs 持续扩散和渗透到肿瘤深处,实现了高达 197 μm 的穿透距离。此外,ML NPs 除了在声动力学疗法 (SDT) 和气体疗法中发挥协同作用外,还可以降低肿瘤细胞内缺氧诱导因子 1-α (HIF-1α) 和热休克蛋白 70 (HSP 70) 的表达,诱导免疫原性细胞死亡,并与肿瘤细胞表面的共刺激分子 LFA-1 结合,从而增强 CD8+ T 细胞的特异性细胞毒性。这种机制显着改善了对癌细胞的免疫反应,并有效抑制了肿瘤转移。我们的研究提出了一种可行的新策略,用于纳米颗粒深入肿瘤和有效的深部肿瘤治疗,证明了此类材料在增强抗肿瘤疗效方面的巨大潜力。

在肿瘤治疗的漫长探索中,如何让药物突破层层屏障直达病灶核心,一直是一个巨大的挑战。传统的治疗方法常常因为难以深入肿瘤内部而导致复发和转移,而提高剂量又不可避免地伤害健康组织。近期,一项创新研究提出了一种全新的纳米颗粒递送策略,它巧妙利用肿瘤自身微环境的酸性梯度,驱动纳米药物实现前所未有的深层渗透,为抗肿瘤治疗打开了崭新的大门。
这项研究设计了一种名为ML NPs的新型纳米颗粒,它以氟化镁(MgF₂)为载体,负载了碱性氨基酸L-精氨酸。肿瘤内部从外到内存在着明显的pH梯度,越往核心酸性越强。ML NPs正是利用这一特点,在酸性环境中其表面氨基选择性质子化,形成空间电荷不对称,进而在肿瘤内源性氢离子梯度的驱动下,发生自主电泳运动。实验表明,这种自推进机制使ML NPs能够持续向肿瘤深处扩散,穿透距离最高可达197微米,远超传统依赖被动扩散的纳米药物。
除了卓越的穿透能力,ML NPs还具备多功能的协同治疗效应。其中,MgF₂成分具有类过氧化物酶活性,可在肿瘤内源性过氧化氢存在下催化产生具有细胞毒性的羟基自由基。在超声波照射下,这一过程被进一步放大,产生的活性氧不仅可直接杀伤肿瘤细胞,还能氧化L-精氨酸产生一氧化氮气体,实现声动力治疗与气体治疗的协同。此外,纳米颗粒释放的镁离子能与肿瘤细胞表面的共刺激分子LFA-1结合,从而增强CD8⁺ T细胞的特异性杀伤功能,激活抗肿瘤免疫应答。
研究团队通过一系列体外实验验证了ML NPs的性能。在模拟肿瘤酸性条件的微流控通道中,ML NPs表现出明显的趋酸迁移行为。在三维肿瘤球模型中,ML NPs成功实现了从外围到核心的梯度扩散,而普通MgF₂纳米颗粒则大多滞留在球体表面。细胞实验进一步显示,在超声波协同下,ML NPs能有效提升细胞内活性氧与一氧化氮水平,显著诱导肿瘤细胞凋亡,并下调缺氧诱导因子HIF-1α和热休克蛋白HSP70的表达,破坏肿瘤细胞的自我保护机制。
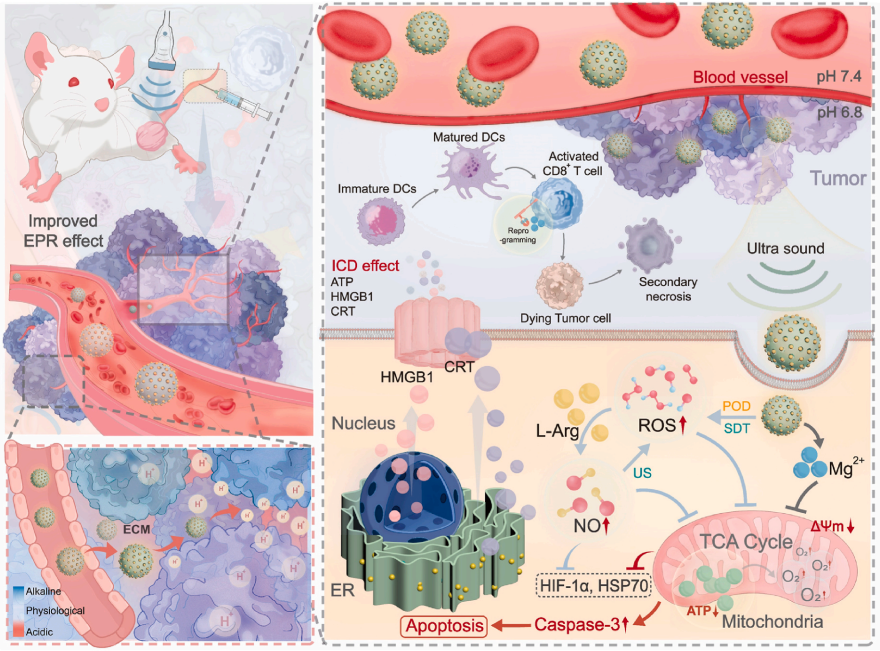
在动物实验中,ML NPs同样表现突出。在4T1乳腺癌小鼠模型中,经尾静脉注射的ML NPs能借助增强渗透与滞留效应主动富集于肿瘤部位,并在酸性梯度驱动下向深部浸润。联合超声波治疗后,肿瘤生长得到显著抑制,瘤内细胞凋亡信号增强,同时伴随树突状细胞成熟与T细胞浸润增加,显示出良好的免疫激活效果。更令人鼓舞的是,该治疗还能有效抑制肿瘤向肺部的转移,展现出预防复发的潜力。
综上所述,这项研究不仅提供了一种基于肿瘤自身微环境特性的智能递送新策略,更通过声动力、气体治疗与免疫调节的多重协同,实现了对深层肿瘤的有效杀伤与免疫激活。ML NPs的成功构建,为突破实体瘤治疗中的渗透壁垒提供了可行的纳米技术方案,也为未来临床转化奠定了重要的实验基础。随着此类精准、高效且系统性毒性可控的治疗平台不断发展,肿瘤治疗有望迈向更深入、更彻底的新阶段。
参考消息:
DOI: 10.1016/j.biomaterials.2025.123398
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫