
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

食物过敏由对膳食过敏原的异常免疫反应引发,可能引发严重甚至危及生命的反应。目前的治疗方法仍受限于部分疗效和长期疗程。本文介绍了一种由巨噬细胞膜衍生纳米颗粒和大肠杆菌 Nissle 1917 益生菌组成的生物杂交配方,用于针对食物过敏的靶向多模式口服治疗。纳米颗粒被装载着一种可降解过敏原的酶,并通过点击化学接轭作用在益生菌上。该设计使生物杂交体能够中和促炎细胞因子,降解过敏原,并增强肠道靶向和保留能力。体外,该制剂显示出强烈的细胞因子结合力和有效的过敏原降解能力。在酪蛋白和麸质诱发过敏的小鼠模型中,口服该生物杂交药物可抑制炎症细胞因子,恢复肠道微生物多样性,缓解体重减轻、腹泻和免疫球蛋白 E 水平升高等症状。组织学分析显示肠道结构得以保存,未观察到全身性或胃肠道毒性,表明该生物杂交系统的耐受性良好。

近期,一项发表于《ACS Nano》的研究展示了一种用于治疗食物过敏的新型口服生物杂化系统,为应对日益增长的食物过敏问题提供了新思路。该系统巧妙地将巨噬细胞膜纳米颗粒与益生菌大肠杆菌Nissle 1917相结合,构建了一种名为“EcN-MΦNP(dpp)”的多功能口服纳米治疗剂。
该系统的核心在于其精妙的设计。首先,研究人员将一种能够降解食物过敏原的酶——二肽基肽酶IV(dpp)封装于金属有机框架纳米颗粒中,形成载酶内核。随后,该内核被一层来源于人巨噬细胞的膜所包裹。这层膜并非简单的屏障,它能“继承”天然巨噬细胞表面的细胞因子受体,从而具备结合并中和促炎细胞因子的能力,直接抑制过敏引发的炎症风暴。
更重要的是,这些装载了酶的膜包纳米颗粒通过无铜点击化学反应,被共价连接到益生菌大肠杆菌Nissle 1917的表面。这一设计使纳米颗粒能够“搭乘”益生菌这艘天然航船。益生菌本身具有定植肠道、增强屏障、调节免疫的特性,同时还能作为一种高效的生物载体,将治疗性纳米颗粒富集并锚定在小肠黏膜上。实验证实,这种生物杂化体系显著延长了纳米颗粒在肠道内的停留时间,从普通纳米颗粒的短暂停留延长至24小时以上。
在体外功能验证中,EcN-MΦNP(dpp)表现优异。它能够高效降解两种代表性过敏原——动物来源的酪蛋白和植物来源的麸质,其降解效率与游离酶相当。同时,得益于巨噬细胞膜的修饰,该体系能够剂量依赖性地结合并中和关键促炎细胞因子IL-6、TNF-α和IL-4。
研究团队随后在两个经典的动物模型——酪蛋白诱导和麸质诱导的食物过敏小鼠模型中验证了其体内疗效。口服给予包裹在肠溶胶囊中的EcN-MΦNP(dpp)后,治疗组小鼠的过敏症状得到显著缓解。与对照组相比,治疗组小鼠体重恢复明显,腹泻和过敏性休克评分大幅降低,血清中过敏原特异性IgE水平显著下降,小肠组织的炎症细胞因子水平也恢复至接近正常水平。
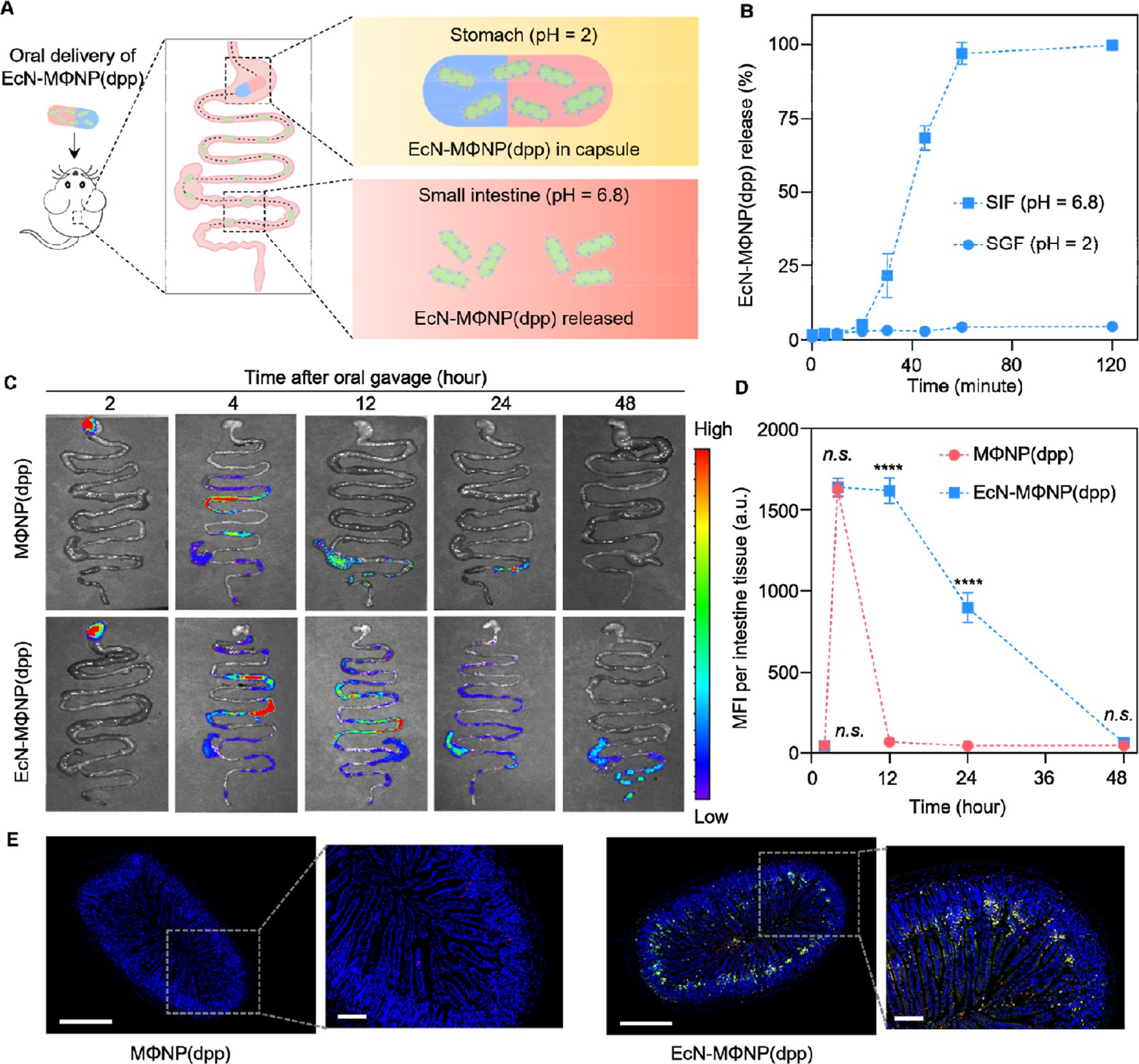
组织病理学分析进一步证实了治疗效果。未治疗或仅用单一组分治疗的过敏小鼠小肠出现明显的病理损伤,如绒毛缩短、杯状细胞减少、上皮完整性破坏和大量炎性细胞浸润。而接受EcN-MΦNP(dpp)治疗的小鼠,其小肠组织结构得到了良好保护,几乎与健康小鼠无异。
除了直接的治疗作用,该体系还对肠道微生态产生了积极影响。16S rRNA测序分析显示,EcN-MΦNP(dpp)治疗有助于恢复因过敏而失衡的肠道菌群多样性,提升了菌群的丰富度和均匀度,并改善了厚壁菌门与拟杆菌门的比例,减少了促炎相关的变形菌门丰度。
在安全性方面,短期体内生物安全性评估结果良好。治疗期间小鼠体重稳定,血液学指标和血清生化指标未见异常,主要器官及胃肠道各段组织学检查均未发现毒性损伤或显著的免疫反应迹象,表明该生物杂化系统具有良好的体内耐受性。
总体而言,这项研究开创性地将细胞膜仿生纳米技术、酶疗法与益生菌载体相结合,构建了一种能够同时实现过敏原降解、炎症中和与肠道靶向滞留的多模式口服治疗平台。它为解决食物过敏治疗中面临的脱敏不持久、靶向性差、系统性副作用等挑战提供了一种有前景的新策略。当然,该技术从实验室走向临床仍需克服规模化生产、长期稳定性、更全面的长期安全性评估等转化挑战,但其展现出的综合疗效与良好安全性,无疑为食物过敏的精准治疗带来了新的希望。
参考文献:
DOI: 10.1021/acsnano.5c18828
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫