
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

淋巴结(LNs)是适应性免疫的核心枢纽,负责 T 细胞激活和长期免疫监测,是癌症免疫治疗的主要靶点。然而,其固有的免疫抑制微环境和传统治疗的系统性分布常常限制了抗肿瘤疗效并增加非靶向毒性。LN 靶向纳米药物通过增强抗原呈现、激活 LN 中的 T 细胞和逆转免疫抑制,同时最大限度地减少全身暴露,提供了一种有前景的策略,克服这些局限性。LN 靶向的关键策略包括:(1)被动靶向,优化纳米颗粒的尺寸、电荷和变形性,以有利淋巴吸收和 LN 的积累(2)主动靶向,利用配体-受体相互作用选择性地结合 LN 驻留免疫细胞或淋巴结构以及(3)受控药物释放,使药物能够持续且局部地传递,增强免疫调节效果。本综述探讨了免疫抑制性 LN 微环境及其有效纳米医学递送的障碍,随后全面概述了 LN 靶向纳米医学设计,强调功能优化策略。通过整合机制学见解和设计原则,我们勾勒出未来发展 LN 靶向免疫疗法的方向,这些疗法增强抗肿瘤免疫力,促进持久记忆反应,并提升临床可翻译性。
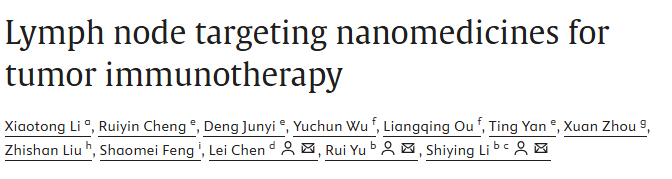
近年来,肿瘤免疫治疗在癌症治疗领域展现出巨大潜力。然而,传统免疫疗法仍面临全身毒性、疗效不均等挑战。淋巴结作为适应性免疫的核心枢纽,其免疫抑制微环境常常阻碍有效抗肿瘤免疫的建立。针对淋巴结的纳米药物递送策略,正成为突破这些瓶颈的重要方向。
淋巴结靶向纳米药物的核心优势在于能够精准调控药物在淋巴结内的富集与释放,从而增强抗原呈递、激活T细胞,并重塑免疫抑制微环境。目前主要策略包括被动靶向、主动靶向和控释递送三种路径。被动靶向通过优化纳米颗粒的尺寸、表面电荷、形变能力等物理化学性质,促进其经淋巴引流自然富集于淋巴结。研究表明,尺寸在10–100纳米之间、表面呈中性或适度负电荷、具有一定柔软性的纳米颗粒更易穿透淋巴管内皮间隙,实现高效的淋巴结递送。
主动靶向则进一步通过表面修饰特异性配体,如甘露糖、靶向肽或抗体,实现对淋巴结内免疫细胞或淋巴管内皮的特异性识别与结合。例如,修饰CCR7配体的外泌体可定向归巢至肿瘤引流淋巴结;而利用点击化学反应在淋巴结局部构建“锚定”系统,能够显著提升药物在淋巴结内的滞留与免疫激活效果。仿生纳米平台,如细胞膜包覆的纳米载体,兼具天然细胞的靶向性与免疫逃逸能力,为淋巴结靶向提供了更为智能的递送工具。
控释型纳米药物则利用淋巴结微环境中特有的氧化还原状态、酸性pH或特定酶活性作为触发条件,实现药物的定点、定时释放。例如,在富含谷胱甘肽的免疫细胞内,二硫键连接的前药可被快速还原并释放活性成分;而在淋巴结酸性微环境中,pH敏感材料会发生结构变化,促进药物释放与内体逃逸,从而增强抗原交叉呈递与T细胞活化。
尽管淋巴结靶向策略在临床前研究中表现出显著疗效,其临床转化仍面临多重挑战。淋巴结结构复杂、异质性强,纳米颗粒的深层渗透与均匀分布仍待优化。不同患者的淋巴解剖与免疫状态存在差异,影响靶向效率与治疗效果。此外,纳米制剂的大规模生产、稳定性控制以及长期安全性评价也是产业化进程中必须克服的难题。
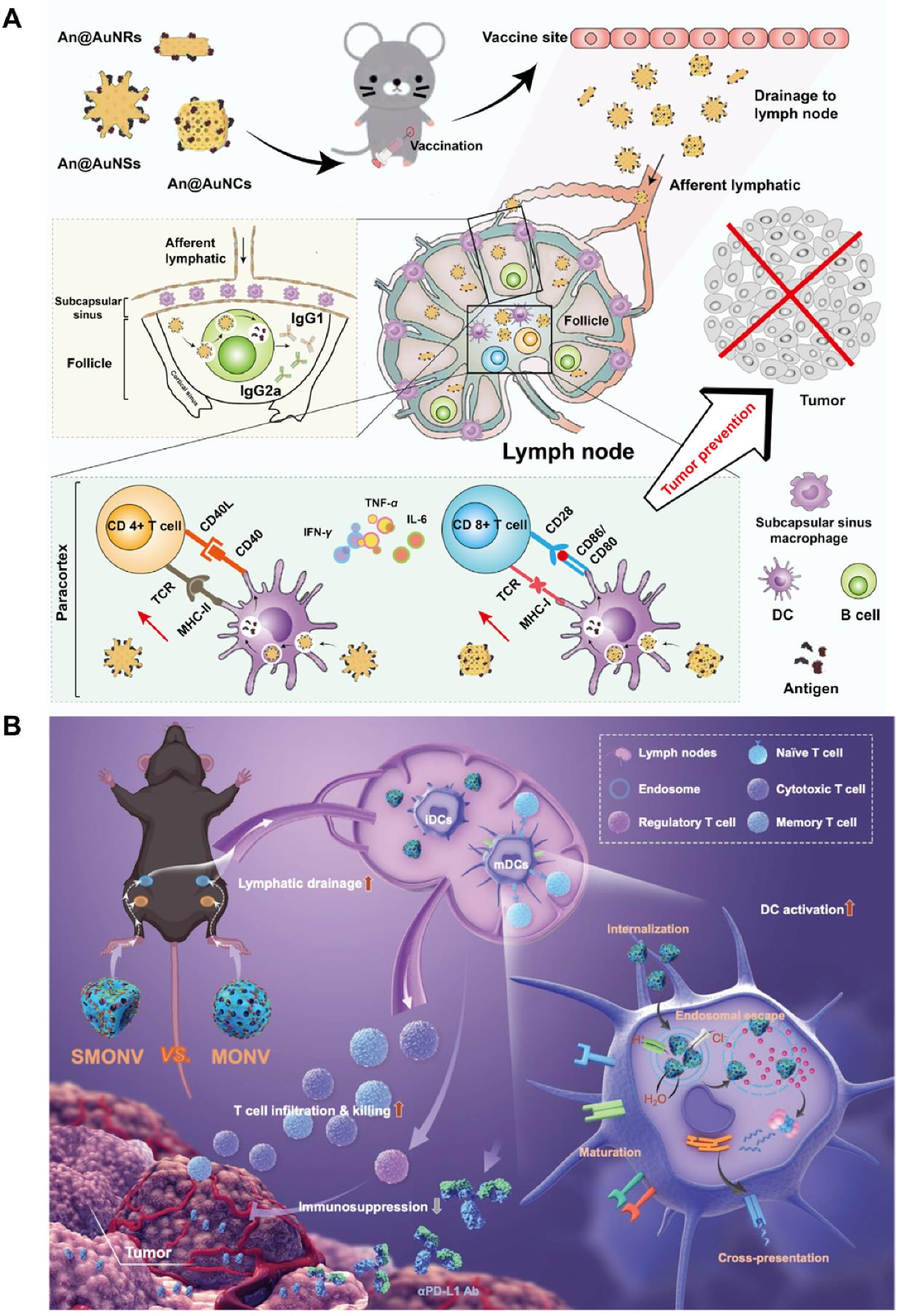
目前,已有部分淋巴结靶向纳米疫苗进入临床研究阶段。例如,基于病毒样颗粒的MelQbG10疫苗、利用白蛋白“搭便车”机制的ELI-002 2P疫苗,以及负载肿瘤抗原的胆固醇修饰纳米凝胶等,均在早期临床试验中显示出良好的安全性与免疫激活潜力。这些进展为淋巴结靶向免疫治疗从实验室走向临床提供了重要支撑。
淋巴结靶向纳米药物不仅有望提升肿瘤免疫治疗的精准性与安全性,还可能拓展至癌症早期诊断、术中导航与预后评估等领域。通过多学科交叉与技术创新,如3D/4D打印、人工智能辅助设计、新型生物材料开发等,未来纳米平台将更加智能化、个性化,最终推动癌症免疫治疗进入一个全新的精准时代。
参考消息:
https://www.x-mol.com/paper/1970562591195164672/t?adv
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫