
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

CD137 是一种强效的 T 细胞共刺激分子,CD137 激动剂正在评估用于人类癌症免疫疗法。Urelumab 和 utomilumab 是两种激动性抗 CD137 抗体,临床试验进展最为先进,但分别存在肝毒性和低效力。本文介绍了一种结合高效能和强安全性的 CD137 激动剂新型和配方的开发过程。方法:重组人类 CD137 配体(rhCD137L)的胞外结构域被结合到直径约 50 纳米的间孔硅纳米颗粒(MSNs)上,并根据其对 T 细胞细胞毒性活性的共刺激能力进行了优化。由于鼻咽癌(NPC)细胞常表达 CD137,使用 NPC 细胞系 C666 和 HK-1(均检测 CD137 表达和缺失变体)评估 rhCD137L-MSNs 对 T 细胞介导肿瘤细胞毒性的体外效应。结果与使用结合 urelumab 的 MSNs(ure-MSNs)或非结合的 urelumab 进行比较。随后在人源化小鼠 NPC 模型中评估了 rhCD137L-MSNs 的生物分布、治疗效果和毒性。结果:rhCD137L-MSNs 在诱导体外杀死 NPC 细胞系 C666 和 HK-1(表达 CD137 和缺失型表型)方面,效力高于 ure-MSNs 或非结合 urelumab。C666-CD137 和 HK1-CD137 细胞的清除效率高于缺失 CD137 的细胞。在体内,人源化小鼠 NPC 模型中,rhCD137L-MSNs 和 ure-MSNs 均抑制肿瘤生长,其中 rhCD137L-MSN 稍强。 这体现在 T 细胞激活标志物的增加以及效应记忆 CD8+ T 细胞进入肿瘤的增加上。与尿路-MSNs 不同,rhCD137-MSN 治疗不会导致肝损伤,因此安全性优于尿路 MSNs。结论:本研究鉴定出一种结合高效力且安全性优异的 MSNs 用 rhCD137L 配方。
2026年1月,一项发表于国际知名期刊的研究,展示了一种针对鼻咽癌治疗的新型纳米免疫疗法。该研究团队成功将重组人CD137配体与介孔二氧化硅纳米颗粒相结合,开发出一种兼具高疗效与高安全性的CD137激动剂,为克服现有免疫疗法瓶颈带来了新希望。
CD137是T细胞上的一个关键共刺激分子,能够有效增强T细胞的抗肿瘤活性。然而,此前进入临床试验的CD137激动性抗体,如强效的urelumab和安全的utomilumab,分别因严重的肝毒性和效力不足而受限。为了解决这一难题,研究人员独辟蹊径,将重组人CD137配体通过肽键连接至直径约50纳米的介孔二氧化硅纳米颗粒上,构建了rhCD137L-MSNs复合物。这种设计不仅使CD137配体实现多聚化从而增强信号激活能力,还利用了纳米颗粒作为载体,旨在改善药物递送与安全性。
研究首先在体外验证了该疗法的效力。在与鼻咽癌细胞系共培养的实验中,rhCD137L-MSNs在诱导T细胞杀伤肿瘤细胞方面,其效力显著优于装载了urelumab或utomilumab的纳米颗粒,甚至优于游离的urelumab抗体本身。尤其值得注意的是,当肿瘤细胞本身表达CD137时,这种增强的杀伤效果更为明显。这表明,rhCD137L-MSNs能够同时靶向肿瘤细胞和T细胞上的CD137,实现双重打击,最大化抗肿瘤免疫反应。
机制研究进一步揭示了其作用原理。当CD137表达于鼻咽癌细胞时,它本是一种免疫逃逸机制,会通过“胞啃作用”消耗抗原呈递细胞上的CD137配体,从而抑制T细胞活化。而rhCD137L-MSNs的到来,如同“反客为主”,不仅能中和肿瘤细胞上的CD137,阻断其免疫抑制功能,还能作为强大的共刺激信号,直接激活T细胞。流式细胞术分析显示,经rhCD137L-MSNs处理的T细胞,其活化标志物和效应分子如CD137、OX40、IFN-γ、TNF的表达均显著上调。
更为关键的突破在于安全性的验证。在构建的人源化小鼠鼻咽癌模型中,rhCD137L-MSNs显示出优异的肿瘤靶向性和生长抑制能力,疗效略优于ure-MSNs。而最重要的发现是,与引发显著肝损伤、体重下降甚至小鼠死亡的ure-MSNs治疗组相比,rhCD137L-MSNs治疗组的小鼠肝脏组织形态正常,肝酶指标与生理盐水对照组无异,展现出卓越的安全性。这解决了制约CD137激动剂临床应用的重大毒性问题。
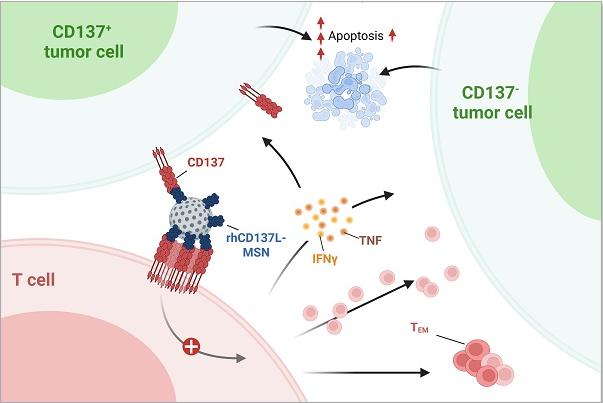
此外,该疗法还能重塑肿瘤免疫微环境。体内实验表明,接受rhCD137L-MSNs治疗的小鼠,其肿瘤内浸润的CD8+ T细胞数量增加,且其中具有效应记忆表型的细胞比例显著上升。这些被活化和增殖的T细胞,构成了持续抗肿瘤免疫监视的基础。
这项研究的成功,不仅仅在于开发了一种针对鼻咽癌的潜在新疗法,更重要的是提供了一种设计新型免疫激动剂的范式。它巧妙地利用纳米技术克服了蛋白质药物在效力、稳定性和毒性方面的传统局限。研究者指出,未来在此纳米平台基础上,还有望进一步整合其他免疫调节分子或肿瘤靶向单元,实现协同治疗。尽管从实验室到临床仍有距离,特别是纳米材料长期生物相容性等细节有待深入评估,但这项研究无疑为开发更安全、更有效的癌症免疫治疗药物点亮了前景,让针对包括鼻咽癌在内的多种实体瘤的免疫治疗拥有了新的可能。
参考消息:
https://www.x-mol.com/paper/1996245486036692992/t?adv
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫