
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

熵驱动的纳米颗粒具有丰富的活性位点和独特的电子结构,赋予其更高的催化效率和选择性,从而有望用于催化肿瘤治疗。然而,中等熵纳米酶(MEzyme)因其内在热力学不稳定性而受到阻碍。本文介绍了同型癌细胞膜涂层超小中等熵纳米酶系统(MEzyme@HCCM),用于靶向 ROS 介导肿瘤治疗的催化。该酶通过通用金属配体交联策略,通过金属离子和配体分子的简单且可扩展的复合物制造。体外结果表明 RuPtIrMo MEzyme@HCCM 表现出优异的过氧化物酶样活性。此外,它们还能通过识别肿瘤细胞中的同源靶蛋白,靶向递送到肿瘤细胞,从而提高肿瘤细胞杀伤效能。体内结果表明,MEzyme@HCCM 能迅速催化内源性过氧化氢,产生高度有毒的羟基自由基,从而实现超过 60%的肿瘤生长抑制。蛋白质组学分析深入揭示了 ROS 介导的通路,包括 DNA 损伤、肿瘤增生抑制、细胞凋亡和细胞自噬。这项工作为酶的制备树立了新的视角,同时开创了其生物医学应用。

癌症治疗领域始终在寻求更精准、更强大的武器,而近年来兴起的纳米酶技术便是其中备受瞩目的新星。纳米酶兼具纳米材料的物理化学特性与天然酶的催化功能,理论上能通过催化肿瘤微环境内的特定反应,实现高效低毒的治疗。然而,传统纳米酶在实战中仍面临两大难题:催化效率有限,难以产生足够强的杀伤力;以及缺乏精准的“导航”能力,易误伤正常组织。最近,一项发表于《Chemical Engineering Journal》的研究提出了一种巧妙策略,通过融合两种前沿概念——中熵合金与同源细胞膜仿生伪装——构建出一种新型靶向催化纳米治疗系统,为破解上述难题提供了创新方案。
研究团队首先攻克了制备超小尺寸中熵合金纳米酶的挑战。他们采用了一种通用性强的金属-配体交联策略,通过钌、铂、铱、钼四种金属盐与多巴胺配体在溶液中共反应,再经退火处理,成功合成了均匀、超小的RuPtIrMo中熵合金纳米酶。中熵合金意味着多种金属原子以近等比例混合,形成一种在热力学上通常不稳定的“高混乱度”结构。正是这种独特的原子排布,赋予了材料丰富的表面活性位点和可调的电子结构,使其在催化性能上展现出超越单一或双金属材料的巨大潜力,这为高效催化反应奠定了基础。
然而,仅有强大的“引擎”还不够,精准的“制导系统”同样关键。为了赋予纳米酶靶向肿瘤的能力,研究团队从仿生学中汲取灵感,为其披上了一层精妙的“伪装”。他们提取了同种癌细胞(同型)的细胞膜,通过超声辅助自组装的方式,将这层天然的生物膜完整地包裹在中熵合金纳米酶表面,构建出最终的MEzyme@HCCM系统。这层同源癌细胞膜就像一张“身份证”,表面保留了癌细胞特有的多种蛋白标志物。当MEzyme@HCCM进入体内循环后,能凭借这些同源识别信号,巧妙地避开免疫系统的早期清除,并精准“归巢”至表达相同标志物的肿瘤组织,实现了主动靶向递送。实验数据显示,这种膜包裹策略将纳米酶在肿瘤部位的递送效率提升了约3倍。
集成了高效催化内核与精准靶向外壳的MEzyme@HCCM,在体外和体内实验中均展现出强大的抗肿瘤效力。得益于中熵合金的优化电子结构,MEzyme@HCCM表现出优异的类过氧化物酶活性。这意味着它能够高效催化肿瘤微环境中普遍过量存在的内源性过氧化氢,将其转化为毒性极强的羟基自由基。体外细胞实验证实,这种催化产生的活性氧能有效杀伤肿瘤细胞。密度泛函理论计算则从原子层面揭示了其高效催化的机理。
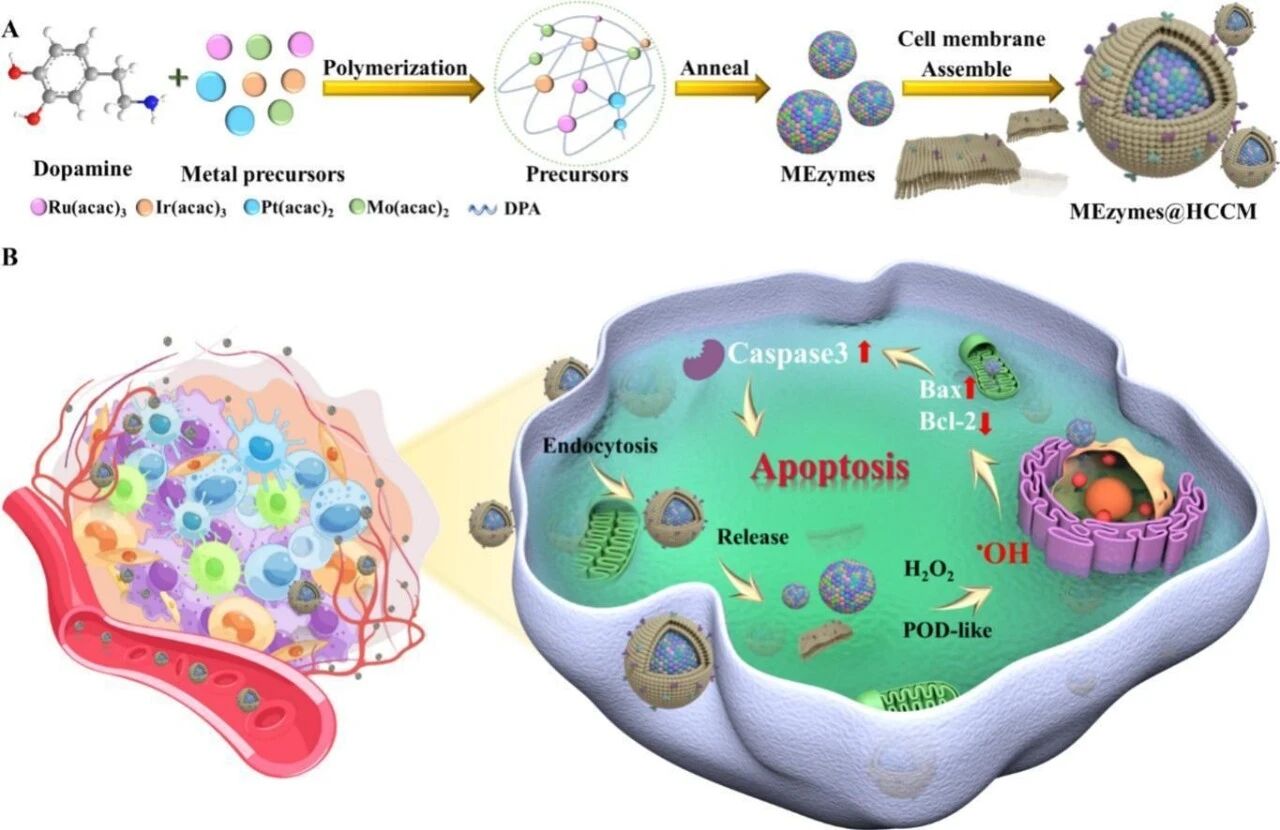
在动物模型中,静脉注射的MEzyme@HCCM能够有效富集在肿瘤部位。通过催化产生大量羟基自由基,引发肿瘤细胞内严重的氧化应激,最终实现了超过60%的肿瘤生长抑制率,且未观察到明显的系统性毒性,显示了良好的治疗安全性。为了深入探究其作用机制,研究人员进行了蛋白质组学分析。结果表明,MEzyme@HCCM通过催化产生活性氧,触发了多重抑制肿瘤的信号通路:包括造成肿瘤细胞DNA损伤、抑制肿瘤细胞增殖、诱导细胞凋亡以及激活细胞自噬。这种多通路协同作用,共同构成了其强大的肿瘤杀伤网络。
这项工作的重要意义在于,它首次将中熵合金材料的概念成功引入纳米酶领域用于肿瘤催化治疗,并通过同源癌细胞膜仿生涂层技术,巧妙地解决了靶向递送难题。这不仅为中熵合金纳米材料的设计与生物医学应用开辟了全新方向,也为发展下一代“诊疗一体化”的智能纳米药物提供了极具启发性的平台。这种“强效催化引擎”与“智能生物导航”相结合的策略,标志着纳米催化肿瘤治疗向着更精准、更高效的目标迈出了坚实的一步。
参考消息:
https://www.x-mol.com/paper/1990134285322006528/t?adv
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫