
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

本文精选
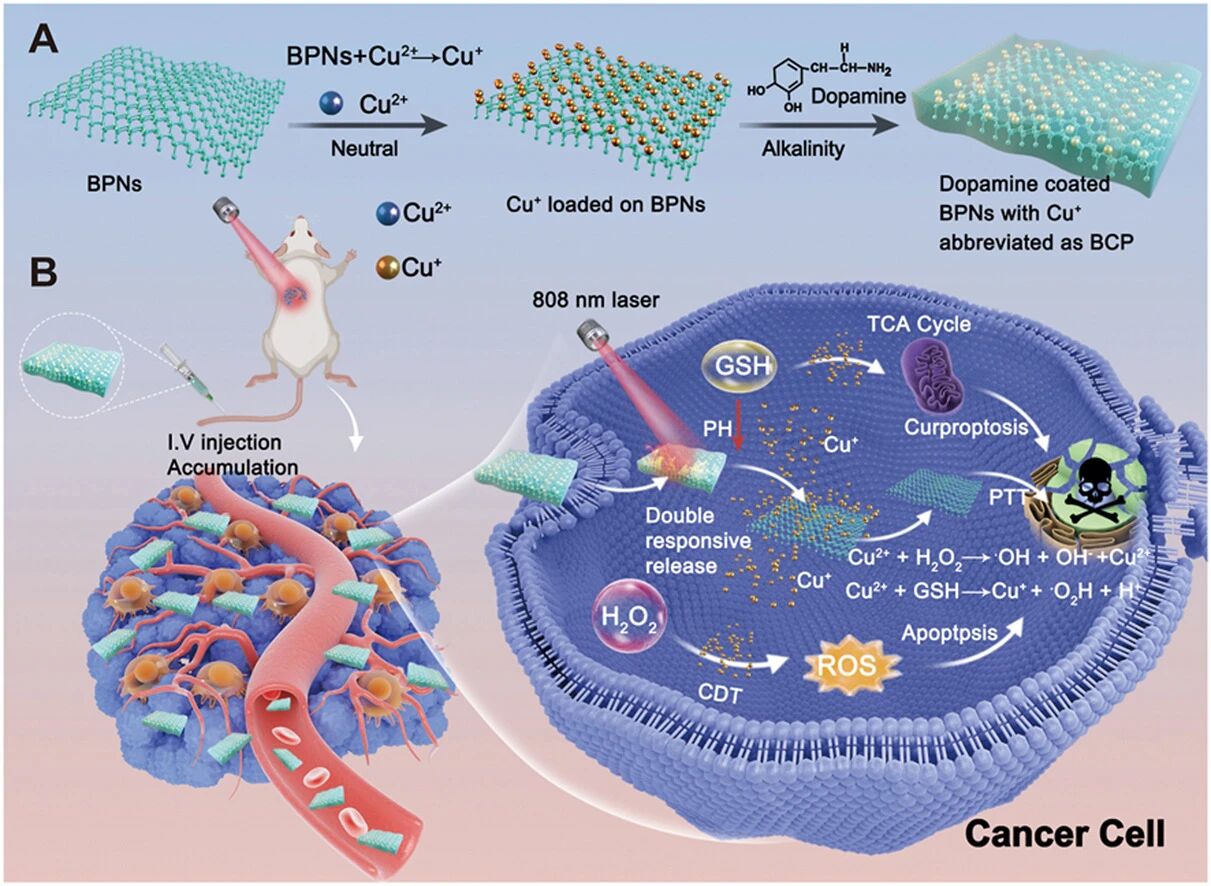
铜死亡是一种新发现的细胞死亡途径。我们的分析表明,该途径与三阴性乳腺癌患者的临床预后密切相关,并可能潜在地促进三阴性乳腺癌的清除。然而,如何以可控方式精准、高效地调控肿瘤区域内的铜死亡仍具挑战。本研究构建了一种基于黑磷纳米片的高效铜死亡诱导剂(BPNs@Cu@PDA,简称BCP),其具备酸响应与热响应的铜离子释放特性,并增强了亚铜离子负载能力。简而言之,BCP通过磷与铜离子之间固有的表面氧化还原反应,有效提高了亚铜离子的负载比例,从而显著提升铜死亡诱导能力。在肿瘤区域富集后,BCP能响应多巴胺修饰所创造的光热作用及酸性微环境,精准释放亚铜/铜离子,进而通过铜离子依赖的类芬顿反应高效产生活性羟基自由基,导致三阴性乳腺癌细胞发生显著的氧化损伤。精准释放的亚铜/铜离子进一步抑制铁硫簇的生成,同时引起琥珀酰化蛋白的聚集,导致线粒体功能和三羧酸循环严重紊乱,从而协同诱导显著的铜死亡及后续的三阴性乳腺癌抑制(肿瘤体积减少超过90%)。本研究提出了一种针对三阴性乳腺癌、具有可忽略毒性的新型铜死亡诱导策略,可能为三阴性乳腺癌的临床治疗提供新思路。
创新点
1.本研究首次构建了具备酸与热双重响应特性的黑磷基铜死亡诱导剂(BCP),通过表面氧化还原反应创新性地提高了亚铜离子的负载比例,突破了传统铜递送系统效率低、可控性差的瓶颈。
2.该策略实现了肿瘤微环境下的铜离子精准释放,并耦合光热效应,通过铜离子依赖性类芬顿反应协同生成羟基自由基,将物理催化与生化代谢调控有机结合,从而多途径强化氧化损伤与代谢紊乱。
3.研究不仅验证了BCP在动物模型中高效抑制三阴性乳腺癌的效果,更从机制上揭示了铜离子释放如何通过抑制铁硫簇组装和引发琥珀酰化蛋白聚集,双向破坏线粒体功能,为铜死亡的代谢干预提供了新的实验依据。
原文链接
Efficient on-demand cuproptosis induction against triple-negative breast cancer via dual-responsive black phosphorus nanosheet
Pub Date : 2025-06-13
DOI: 10.1016/j.mtbio.2025.101985
Qiancun Hong, Jiajun Huang, Zhiguo Li, Yue Chen, Jiawei Wang, Tongrui Shang, Zelin Chen, Cong Luo, Yongqiang Wang, Xinghong Tang, Taojian Fan, Songyin Huang, Hao Fu, Yandan Yao
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫