
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

本文精选
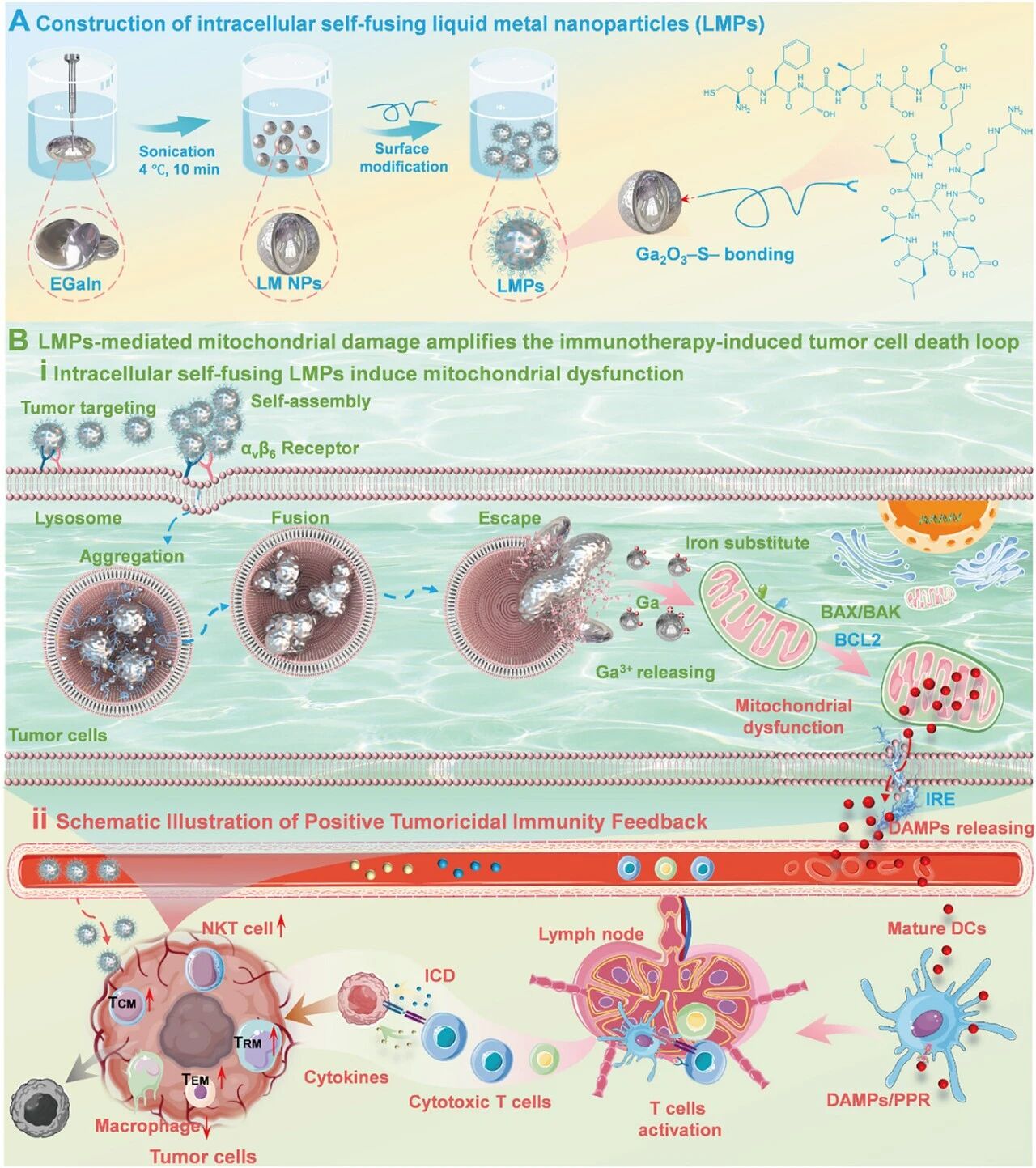
由于免疫抑制性肿瘤微环境(TME)和肿瘤抗原的低免疫原性,癌症疫苗面临局限性。由线粒体功能障碍触发的免疫原性细胞死亡(ICD)是一种有前景的策略,可以增强肿瘤抗原释放和免疫激活。然而,主动扩增线粒体损伤诱导的 ICD 仍然具有挑战性。在这项研究中,我们开发了一种疫苗,其中液态金属纳米颗粒(LMPs)针对肿瘤细胞,在细胞表面进行自我组装和聚集以实现高效摄取,细胞内融合以延长保留时间,并通过铁替代途径释放 Ga 3+离子诱导线粒体损伤,从而触发 ICD。结合不可逆电穿孔(IRE),该方法介导持久的肿瘤特异性免疫疗法。具体来说,LMPs 针对肿瘤细胞整合素αvβ6,启动自组装和聚集,从而实现高效的细胞内化。在酸性溶酶体环境中,LMPs 发生融合并部分逸出至细胞质中,从而实现细胞内长期保留和持续释放 Ga 3+离子。释放的 Ga 3+破坏线粒体结构,并通过铁替代抑制电子运输,导致明显的线粒体损伤。协同的 IRE 和 LMPs 能增加线粒体损伤相关 DAMP 和肿瘤抗原的释放,驱动强健的 ICD 和长期系统性抗肿瘤免疫。这一双模态策略为癌症免疫治疗中纳米材料驱动的 ICD 扩增提供了蓝图。
创新点
1.研究创新性地构建了兼具高效靶向、细胞内自组装与长期滞留功能的液态金属纳米疫苗,其通过特异性靶向整合素αvβ6实现肿瘤细胞膜表面的可控聚集,从而显著提升了细胞摄取效率,这为解决纳米载体靶向递送效率低的普遍难题提供了新思路。
2.提出了“细胞内融合与离子缓释”的新机制,液态金属纳米颗粒在酸性溶酶体环境中发生融合并部分逃逸至胞质,实现了载体在细胞内的长期驻留与Ga³⁺离子的持续释放,这种设计巧妙地将载体行为与细胞内微环境响应相结合,突破了传统纳米颗粒易被快速清除的限制。
3.开创了“铁替代诱导线粒体损伤”与物理消融(IRE)协同扩增免疫原性细胞死亡的协同模式,通过Ga³⁺破坏线粒体电子传递链,从代谢根基上触发强烈的内源性危险信号释放,并与IRE介导的物理性抗原释放相结合,实现了对肿瘤免疫抑制微环境的双重逆转,为癌症疫苗的效能提升提供了全新途径。
原文链接
Liquid Metal Nanoparticles-Mediated Mitochondrial Damage Enhances Immunogenic Cell Death for Cancer Vaccine Therapy
Advanced Materials ( IF 26.8 )
Pub Date : 2026-01-05
DOI: 10.1002/adma.202520580
Yuxia Qi, Zhongyang Yu, Jie Zhang, Chi Zhang, Xiaoshuai Wang, Fan Yang, Yunlong Bai, Jun‐Xiao Yuan, Minghui Guo, Dawei Wang, Kaiwen Hu, Tian Zhou, Lei Wang, Wei Rao
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫