ACS Nano | LRP-1/CD44 靶向雷格拉非尼纳米递送系统,利用抗血管生成和协同细胞毒性对抗结直肠癌腹膜转移
QQ学术交流群:1092348845
详细介绍
结直肠癌腹膜转移(PM-CRC)是晚期疾病中的一大治疗挑战,异常肿瘤血管会导致预后不良。为解决雷戈拉非尼(REG)的药理局限性,本研究开发了一种双受体靶向纳米平台(REG@LFHA NPs),利用结直肠癌肿瘤微环境中 LRP-1 和 CD44 受体的特有过度表达。该纳米平台通过纳米沉淀和静电自组装设计,结合乳铁蛋白靶向 LRP-1 和透明质酸识别 CD44。REG@LFHA NPs 通过三种协调机制发挥多方面的抗肿瘤效应:通过 VEGF-VEGFR 通路阻断有效抑制肿瘤血管,有效干扰血液和氧气供应以诱导肿瘤坏死;通过 REG 介导的细胞凋亡和细胞周期停止直接实现肿瘤细胞毒性;以及通过巨噬细胞从肿瘤前 M2 向抗肿瘤 M1 表型的再极化实现免疫微环境重塑。在 PM-CRC 模型中,REG@LFHA NPs 显著增强了肿瘤积累和治疗效果,相较于游离 REGs。此外,纳米平台与 PM-CRC 的一线化疗剂奥沙利铂表现出显著协同效应,通过互补的作用机制实现更优越的治疗效果。本研究不仅确立了 REG@LFHA NPs 作为有效的双靶向纳米医学的地位,还展示了其在临床转化方面的强大潜力,尤其是在与标准化疗方案结合治疗晚期腹膜转移性结直肠癌时。

结直肠癌(CRC)是全球范围内高发且死亡率居前的恶性肿瘤,其中约20-25%的晚期患者会发生腹膜转移(PM),导致5年生存率长期低于15%,构成了重大的临床治疗挑战。腹膜转移的病理进程高度依赖于肿瘤异常血管网络的建立,这种紊乱的血管不仅为肿瘤生长提供养分,更助长了癌细胞的播散。因此,靶向肿瘤血管生成,联合直接杀伤肿瘤细胞并逆转免疫抑制性微环境,成为对抗这一难治性转移瘤的关键策略。口服多靶点激酶抑制剂瑞戈非尼(REG)因其能同时阻断VEGF/VEGFR通路、诱导肿瘤细胞凋亡并具有独特的免疫调节功能而备受关注,但其水溶性差、生物利用度低以及剂量限制性毒性(如手足综合征)严重限制了其临床应用效果。
为突破这一瓶颈,四川大学华西医院钱志勇教授团队在《生物活性材料》上提出了一项创新性解决方案:他们成功构建了一种基于乳铁蛋白(LF)和透明质酸(HA)的LRP-1/CD44双受体靶向纳米递送系统(REG@LFHA NPs)。该系统的设计灵感源于对结肠癌腹膜转移(PM-CRC)肿瘤微环境的深入洞察:肿瘤细胞、癌症相关成纤维细胞(CAFs)及促肿瘤的M2型肿瘤相关巨噬细胞(TAMs)均高表达低密度脂蛋白受体相关蛋白-1(LRP-1),而CD44受体则在肿瘤细胞、癌症干细胞及多种基质细胞上广泛过表达。研究者利用纳米沉淀与静电自组装技术,将LF(LRP-1的高亲和力配体)作为药物负载核心,并在其表面包裹HA(CD44的天然配体),从而构建出能够同时利用这两条通路实现主动靶向的智能纳米平台。
该双靶向纳米系统展现了卓越的理化特性与递送效率。经过优化的REG@LFHA NPs具有约188纳米的理想流体动力学直径,表面带负电,在模拟腹水环境的4%牛血清白蛋白溶液中表现出优异的胶体稳定性。更重要的是,其在PM-CRC小鼠模型中显示出极强的肿瘤靶向性与滞留能力。腹腔注射后,DiR标记的LFHA NPs在肿瘤区域的荧光信号强度和持续时间均显著优于游离DiR及未修饰HA的对照纳米粒。这种高效靶向的分子基础被随后的受体表达谱分析所证实:免疫荧光与流式细胞术显示,PM-CRC肿瘤组织中LRP-1与CD44的表达水平远高于心、肝、脾、肺、肾等主要脏器,构成了纳米粒精准归巢的“分子地图”。
REG@LFHA NPs的抗肿瘤作用通过三条相互协调的机制协同发挥。首先,其展现出强大的抗血管生成能力。体外实验表明,该纳米制剂能浓度依赖性地抑制人脐静脉内皮细胞(HUVEC)的活力,诱导其发生凋亡并阻滞细胞周期于G1期。更重要的是,它能有效破坏内皮细胞的成管能力,并在分子水平上显著抑制VEGF诱导的VEGFR2磷酸化,从而在源头切断肿瘤的血液与氧气供应。其次,该纳米系统能直接杀伤肿瘤细胞。其负载的REG能有效诱导CT26-luc结肠癌细胞发生晚期凋亡,并导致显著的G1期细胞周期阻滞。第三,也是其最具特色的机制,在于对肿瘤免疫微环境的主动重塑。研究团队发现,载体材料LF本身就具有固有的免疫刺激特性,能单独促进骨髓来源巨噬细胞(BMDMs)从促瘤的M2表型向抗瘤的M1表型极化。而REG@LFHA NPs在此基础上,通过药物与载体的协同作用,进一步放大了这一效应,显著提升了M1巨噬细胞标志物CD86的表达以及促炎因子TNF-α和IL-6的分泌,从而将免疫抑制性的“冷”肿瘤微环境转化为免疫激活的“热”状态。
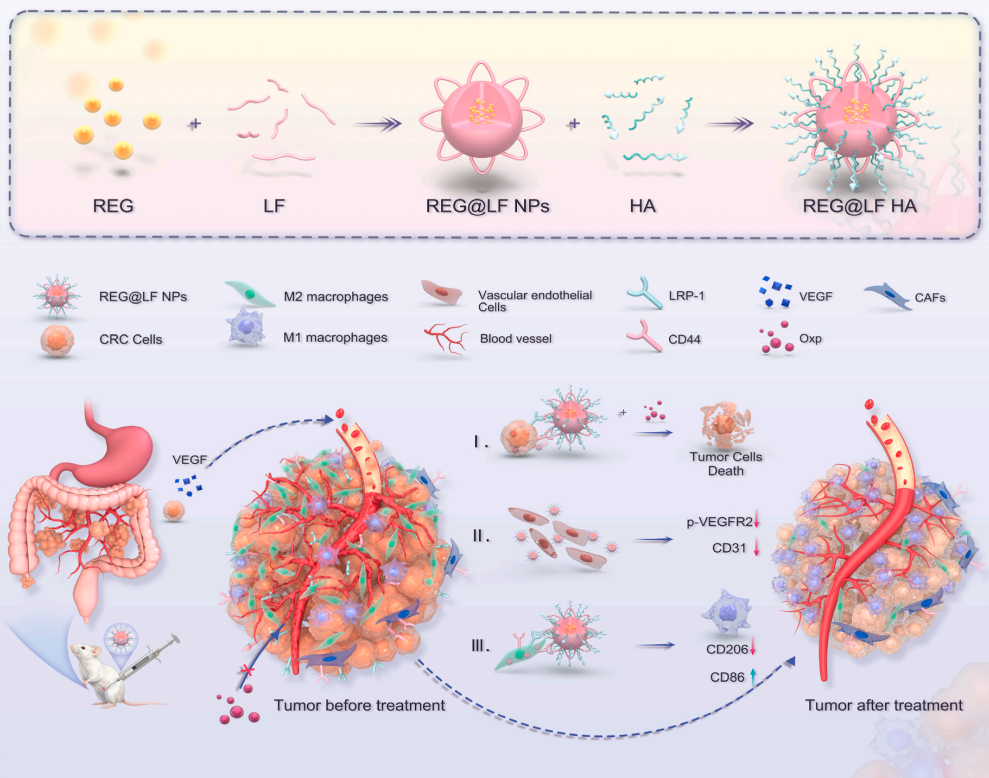
在CT26-luc细胞构建的PM-CRC小鼠模型中,REG@LFHA NPs单药治疗即展现出显著优于游离REG的抗肿瘤效果,将肿瘤重量和生物发光信号分别抑制了78.0%和64.5%。肿瘤组织宏观上呈现特征性苍白,提示血管受损及继发性坏死。深入的肿瘤微环境分析揭示了其作用全景:免疫荧光显示,治疗组肿瘤内CD31阳性的病理性血管密度降低了73.6%,同时CD206阳性的M2型巨噬细胞浸润减少了69.4%;流式细胞术则证实肿瘤组织中F4/80⁺CD86⁺的M1型巨噬细胞比例大幅提升了87.3%。这种血管抑制与免疫重塑的双重效应,共同导致了肿瘤内部严重的缺血缺氧,诱导了HIF-1α的高表达,形成了不利于肿瘤生长的微环境。
尤为引人注目的是,该纳米平台与一线化疗药物奥沙利铂(OxP)联用产生了卓越的协同增效作用。体外实验显示,两者联合在3D肿瘤球及2D培养中均能诱导更强的细胞死亡,联合指数(CI)小于1,证实了明确的协同关系。机制研究表明,REG@LFHA NPs主要驱动G1期阻滞与凋亡,而OxP通过造成DNA损伤间接激活G1检查点,两者在细胞周期调控上形成互补,共同强化了G1期阻滞效应。在体内,REG@LFHA NPs与奥沙利铂的联合治疗方案取得了最强的抗肿瘤效果,肿瘤抑制率高达90.3%,且未观察到明显的系统性毒性,主要器官组织学形态及血清生化指标均保持正常。
这项研究不仅成功开发了一种高效、安全的双靶向纳米递送系统,更通过多维度机制阐明了其通过“抗血管生成-直接细胞毒杀-免疫微环境重塑”三位一体的协同策略对抗腹膜转移性结肠癌的强大潜力。该工作巧妙地将靶向递送、常规化疗与免疫调节相结合,为克服REG的临床应用局限、提升晚期结直肠癌腹膜转移的治疗效果提供了一条极具转化前景的新途径。
参考消息:
DOI: 10.1016/j.bioactmat.2025.12.015
- 上一款: Cell | 多模态超分子靶向嵌合体使蛋白质
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿