Cell | 多模态超分子靶向嵌合体使蛋白质在体内时空分解成为可能
QQ学术交流群:1092348845
详细介绍
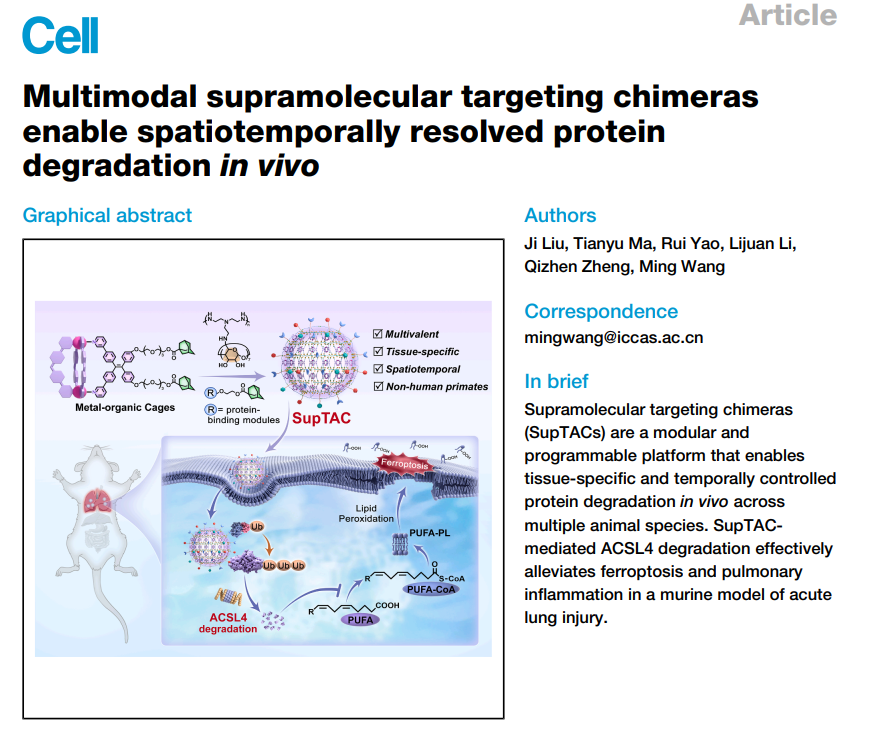
靶向蛋白质降解(TPD)改变了基础生物学和治疗开发中调节蛋白质功能的策略。然而,现有策略往往缺乏体内应用所需的空间和时间精度。本文报告超分子靶向嵌合体(SupTAC),这是一种模块化且可编程的平台,能够实现组织特异性且时间控制的蛋白质降解。SupTACs 自我组装成超分子纳米颗粒(SNP),共同定位靶点结合配体和 E3 连接酶招募子,从而通过多价超分子的接近促进蛋白酶体降解。该策略在多种物种(甚至非人灵长类)中实现了强健且组织特异性的降解,包括肝脏和肺部特异性。作为概念验证,利用 SupTACs 特异性降解酰辅酶 A(CoA)合成酶长链家族成员 4(ACSL4)能有效减轻急性肺损伤小鼠模型中的铁分子凋亡和肺部炎症。通过整合模块化、组织特异性和时间调控,SupTACs 建立了一个多功能平台,用于精确控制蛋白质降解,用于探究动态信号网络并开发靶向治疗药物。
在靶向蛋白降解领域,一项由中国科学家团队取得的突破性进展正为精准治疗带来全新可能。中国科学院化学研究所的王明研究员及其合作者近期在《细胞》杂志上报道了一种名为“超分子靶向嵌合体”的创新平台。该平台通过模块化设计与可控自组装,首次在活体内实现了兼具组织特异性与时间分辨率的蛋白质降解,标志着靶向蛋白降解技术向临床转化迈出了关键一步。
传统靶向蛋白降解策略,如蛋白水解靶向嵌合体,虽能利用泛素-蛋白酶体系统选择性清除疾病相关蛋白,极大拓展了成药蛋白质组的范围,但在实际应用中,尤其是活体层面,仍面临空间与时间控制精度不足的核心挑战。生理环境下蛋白质功能常受动态时空信号调控,因此实现降解过程的时空精准操控对机制研究与治疗应用至关重要。现有方法或受限于组织限制性E3连接酶的狭窄表达谱,或因组织特异性差、光穿透效率低等问题难以在活体内有效应用。
SupTAC技术的核心在于其精巧的模块化设计。该系统由金刚烷功能化的金属有机笼与β-环糊精共轭聚乙烯亚胺通过主客体相互作用自组装形成超分子纳米颗粒。这种自组装方式允许将靶蛋白结合配体与E3连接酶募集分子模块化地整合并空间组织于纳米颗粒表面,通过多价相互作用与超分子邻近效应,高效引导泛素-蛋白酶体系统对目标蛋白进行降解。研究人员证明,SupTAC不仅能高效降解细胞内靶点如BRD4,对膜相关蛋白EGFR同样有效,且能通过共组装不同靶向模块,实现同时对BRD4与EGFR的多重降解,展现了其用于开发多价蛋白降解剂的潜力。
更引人注目的是,SupTAC平台实现了从啮齿类到非人灵长类等多个物种中稳健的组织特异性蛋白降解。通过调节纳米颗粒组装组分比例,可精确调控其表面电荷与蛋白冠组成,从而特异性地靶向肝脏或肺部。例如,组装比例为10:1的SupTAC在静脉注射后选择性地在肺部富集,而比例为6:1的变体则主要靶向肝脏。机制研究表明,肺部靶向依赖于纳米颗粒表面吸附的玻连蛋白及其与肺组织高表达的玻连蛋白受体间的相互作用;而肝脏靶向则由载脂蛋白E介导,通过低密度脂蛋白受体途径实现。这种利用内源性受体-配体系统实现组织靶向的能力,为理性设计组织特异性降解剂提供了通用框架。
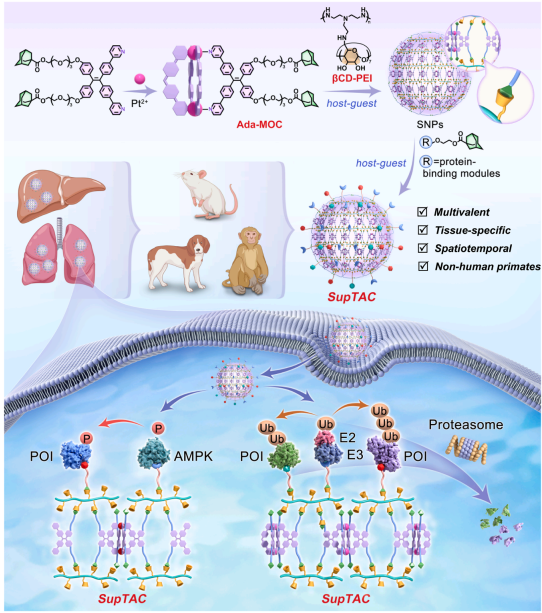
在时间控制维度,研究团队通过设计化学笼蔽的SupTAC变体,实现了蛋白降解的按需激活。例如,将对氨基苯甲酰氧基羰基保护基团连接到E3连接酶募集分子上,可使其暂时失活;在活体内通过生物正交的斯塔丁格还原反应移除保护基后,即可在特定时间点恢复降解活性。这种“化学笼蔽-激活”策略为在动态生物过程中精确研究蛋白功能提供了强大工具。
为展示其治疗潜力,团队构建了靶向肺特异性降解长链脂酰辅酶A合成酶4的SupTAC。ACSL4是铁死亡的关键调节因子。在脂多糖诱导的急性肺损伤小鼠模型中,肺特异性降解ACSL4能有效降低肺组织脂质过氧化物水平,显著减轻肺部血管渗漏与炎症因子浸润,改善肺组织病理损伤,证明了该策略在治疗铁死亡相关肺部炎症中的预防与治疗价值。值得注意的是,此效应在比格犬及恒河猴等大型动物模型中同样得到验证,凸显了其转化潜力。
在生物相容性方面,研究显示SupTAC系统具有较好的安全性。药代动力学研究表明其在血浆中清除较快,半衰期约5.5小时,但在靶组织肺中能持续滞留数日,实现长效降解。最大耐受剂量研究也表明其具有较宽的治疗窗口。
当然,该技术仍存在进一步探索空间,例如将其调控范围拓展至磷酸化以外的其他翻译后修饰,开发由疾病微环境内源性信号激活的下一代智能系统,以及突破血脑屏障等特殊生物屏障实现中枢神经系统靶向等。尽管如此,SupTAC成功地将空间特异性、时间可控性、多价效应与模块化设计整合于一体,建立了一个可在活体复杂环境中对蛋白降解进行精确编程的通用平台。它不仅为深入解析动态生物过程提供了前所未有的利器,也为开发针对器官特异性疾病的下一代靶向治疗奠定了坚实的技术基础,预示着精准医学一个崭新方向的到来。
参考消息:
DOI: 10.1016/j.cell.2025.12.007
- 上一款: Nature Nanotechnology
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿