Nature Nanotechnology | 工程化黏液系结合双特异性纳米抗体增强了对呼吸道病原体的黏膜免疫力
QQ学术交流群:1092348845
详细介绍
尽管疫苗和抗病毒药物研发取得了进步,但全球范围内预防呼吸道病毒感染和传播仍是一项重大挑战。这些方法的一个明显局限是,它们在感染初期部位——呼吸道黏膜——无法提供强有力的保护。目前,增强黏膜免疫对呼吸道病原体的策略仍然缺乏。我们设计了黏液系附的双特异纳米抗体,设计用于通过结合病毒表面蛋白实现同时中和病毒,并通过将其固定在黏液中来捕获病毒。与传统非黏液系纳米抗体相比,这些黏液系结合双特异性纳米抗体在呼吸道的保留能力增强,在小鼠中增强了对流感病毒感染的保护,并减少了仓鼠中 SARS-CoV-2 的传播。我们的发现共同代表了一种有前景的策略,通过阻断病毒进入和限制传播,增强黏膜防御呼吸道病毒的能力。

在呼吸道病毒感染的全球防控中,黏膜免疫一直是亟待加强的薄弱环节。传统疫苗和抗病毒药物虽能减轻重症,但往往难以在病毒入侵的第一道防线——呼吸道黏膜——建立及时且持久的保护。2026年1月发表于《自然·纳米技术》的一项突破性研究,提出并验证了一种全新的黏膜防御策略:工程化改造的“黏液栓系双特异性纳米抗体”。该策略通过同时靶向病毒表面蛋白与呼吸道黏液中的黏蛋白,将病毒颗粒牢牢固定在黏液层中,从而阻止其接触并感染上皮细胞。
这项研究首先证实了黏液层的保护作用依赖于黏蛋白。利用人源肺上皮细胞Calu-3产生的黏液,研究人员发现外源性黏液能显著抑制H1N1流感病毒感染,而使用黏蛋白选择性蛋白酶StcE降解黏液后,这种保护作用随之消失。内源性黏液实验进一步表明,使用白细胞介素-13刺激黏蛋白分泌可降低病毒载量,反之,降解黏蛋白则增加病毒RNA水平。这为通过增强病毒与黏蛋白的相互作用来提升黏膜防御提供了理论依据。
基于此,研究团队着手开发能同时结合黏蛋白和病毒的双特异性纳米抗体。纳米抗体源自骆驼科动物的重链抗体,其单体可变域结构小巧,易于工程化改造,且无Fc段,可避免不必要的免疫反应。研究人员采用酵母表面展示技术,从一个包含超过5亿个合成序列的文库中,快速筛选出针对人源黏蛋白MUC5AC的高亲和力纳米抗体Nb.H17,以及针对小鼠Muc5ac的Nb.M6。同时,针对甲型流感病毒H1N1的血凝素蛋白和新冠病毒SARS-CoV-2的刺突蛋白,也分别筛选出了强效中和纳米抗体Nb.19和Nb.S13iD。
随后,他们将病毒中和纳米抗体与黏液结合纳米抗体以头尾相连的方式融合,构建出双特异性纳米抗体,例如靶向H1N1和鼠黏蛋白的Nb.19-M6。体外实验证明,在存在黏液的情况下,这种栓系型纳米抗体的保护效果显著优于非栓系对照抗体。更为重要的是,体内成像显示,经鼻给药后,栓系型纳米抗体在呼吸道(尤其是肺部)的滞留时间显著延长,信号可持续超过72小时,这为其发挥长效保护作用奠定了基础。
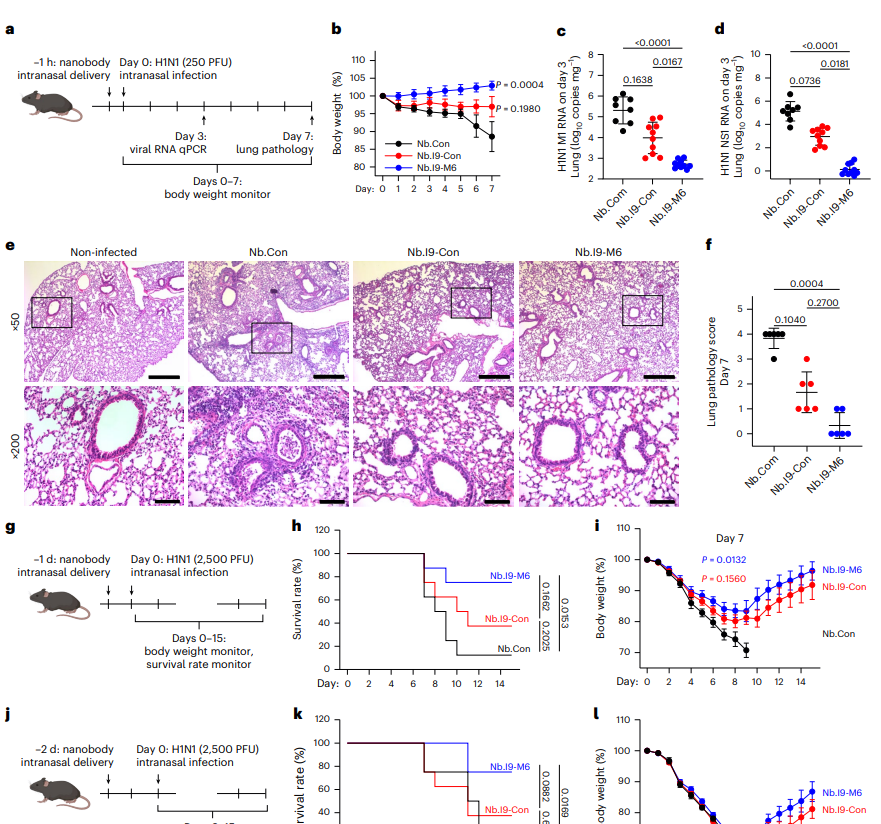
在动物模型验证中,该策略展现出卓越的防护与治疗效果。在小鼠H1N1感染模型中,预防性给予Nb.19-M6能显著降低小鼠体重丢失、肺内病毒载量和病理损伤,即使在高剂量病毒攻击或给药后48小时再感染的严苛条件下,仍能有效提高存活率。在治疗性实验中,感染后给药也能减缓疾病进程。此外,在模拟真实世界传播的仓鼠新冠病毒共居模型中,使用靶向SARS-CoV-2刺突蛋白与仓鼠黏蛋白的双特异性纳米抗体Nb.S13iD-M6进行预处理,能够显著降低从感染供体仓鼠到受体仓鼠的病毒传播,体现其阻断人际传播的潜力。
该研究首创的“黏液栓系”策略,本质上是一种被动免疫强化手段。它不同于需要数周时间才能建立保护的黏膜疫苗,而是提供了一种即时的物理屏障,通过将病毒“锚定”在黏液层,并借助黏液纤毛清除系统将其排出。这种机制不依赖于个体免疫应答,且作用快速,在暴露前或暴露后均可使用。研究同时指出,未来可通过优化纳米抗体对特定物种黏蛋白的亲和力,或靶向病毒表面更保守的区域,以应对病毒变异并拓展其应用范围。
这项成果不仅为预防呼吸道病毒感染和传播提供了一种极具前景的新型生物制剂平台,也拓宽了针对呼吸道疾病的靶向给药思路。通过巧妙利用人体原有的黏膜防御系统,并借助纳米抗体工程进行功能强化,该研究为应对流感、新冠等当前及未来呼吸道病毒威胁,开辟了一条富有吸引力的创新路径。
参考文献:
DOI: 10.1038/s41565-025-02107-8
- 上一款: Advanced Functional Ma
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿