ACS Nano | 负载热敏瑞喹莫特的脂质纳米颗粒促进肿瘤相关巨噬细胞的极化以增强膀胱癌免疫治疗
QQ学术交流群:1092348845
详细介绍
膀胱癌是一种常见的泌尿系统恶性肿瘤,与高发病率、复发率和死亡率相关。使用免疫检查点抑制剂的免疫疗法在膀胱癌中显示出很好的治疗效果和安全性。免疫检查点抑制剂也被批准作为治疗局部晚期或转移性膀胱癌的一线和二线药物。然而,免疫疗法对癌症免疫疗法的反应和药物辅助作用较低,这可能归因于肿瘤微环境中抗原呈递不足、肿瘤免疫抑制细胞积累和 T 淋巴细胞耗竭。为了克服免疫疗法的缺点,我们制备了一种负载瑞喹莫特 (R848)/光热剂 (DTPA) 的脂质纳米颗粒 (R848/DTPA@DSPE-PEG NP),它显示出良好的光热转换效率、生物安全性和生物相容性。激光照射 (635 nm) 的 R848/DTPA@DSPE-PEG NPs 可损伤 MB49 细胞并在体外诱导免疫原性细胞死亡,从而触发免疫反应。同时,R848/DTPA@DSPE-PEG NPs 还可以在体外促进 M1 样巨噬细胞极化和树突状细胞成熟。此外,R848/DTPA@DSPE-PEG NPs 具有 635 nm 激光照射可抑制皮下和原位膀胱肿瘤生长并激活免疫反应,可促进树突状细胞成熟和 M1 样巨噬细胞极化,增强 CD8+ T 淋巴细胞浸润,减少肿瘤中 M2 样巨噬细胞极化。生物信息学分析发现,R848/DTPA@DSPE-PEG NPs 还可以诱导免疫信号通路的免疫相关基因过表达。 R848/DTPA@DSPE-PEG NPs 与 PD-1 抗体联合使用可显著增强抗肿瘤治疗效果,重编程肿瘤免疫抑制微环境,延长生存时间。

本研究报道了一种新型热敏性R848负载脂质纳米颗粒(R848/DTPA@DSPE-PEG NPs),旨在通过光热-免疫联合疗法增强膀胱癌的治疗效果。膀胱癌作为一种高发病率、高复发率和高死亡率的泌尿系统恶性肿瘤,传统免疫检查点抑制剂治疗虽有一定成效,但其应答率较低,易受肿瘤免疫抑制微环境的限制。该研究通过合成兼具光热转换能力与免疫佐剂功能的纳米颗粒,有效克服了单一疗法的局限性,为膀胱癌免疫治疗提供了创新策略。
该纳米颗粒以DSPE-PEG为载体,同时负载光热剂DTPA与免疫调节剂R848,在635 nm激光照射下表现出优异的光热稳定性与升温性能,并能在酸性肿瘤微环境中实现R848的控释。体外实验显示,该纳米系统具有良好的生物相容性,可被膀胱癌细胞MB49及巨噬细胞RAW264.7有效摄取。经激光照射后,纳米颗粒可通过热效应及活性氧生成诱导MB49细胞发生免疫原性细胞死亡,并显著提升CRT、HMGB1、HSP70等免疫激活相关标志物的表达。
进一步研究发现,R848/DTPA@DSPE-PEG NPs能够促进巨噬细胞向M1表型极化,并增强树突状细胞的成熟,从而激活先天性与适应性免疫应答。在皮下与原位膀胱癌小鼠模型中,该纳米颗粒联合激光照射显著抑制了肿瘤生长,并延长了小鼠生存期。机制研究表明,治疗后的肿瘤组织中CD8+ T细胞浸润增加,M1型巨噬细胞比例上升,M2型巨噬细胞与髓源性抑制细胞比例下降,表明肿瘤免疫微环境由“冷”向“热”转变。
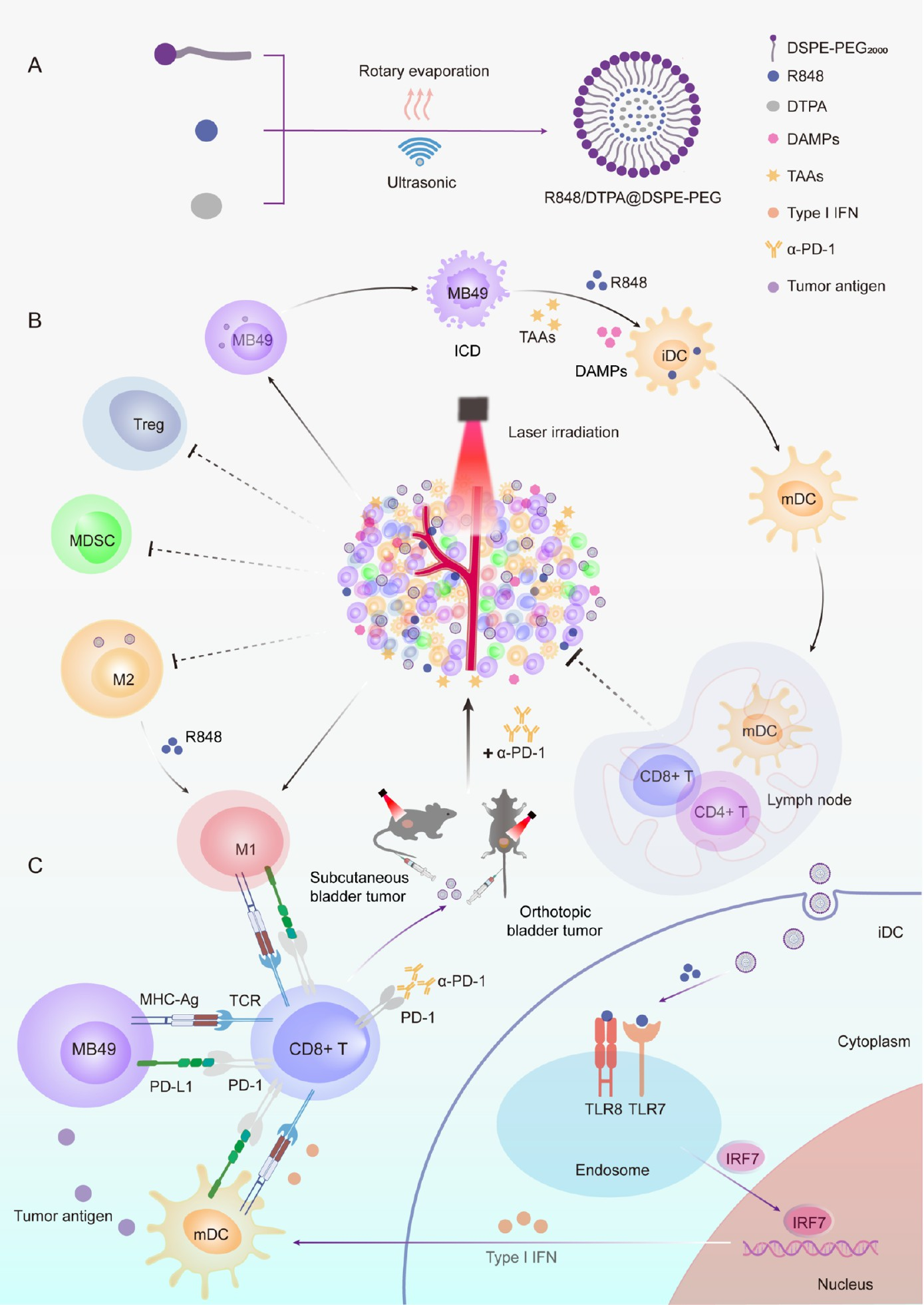
研究进一步将纳米颗粒与PD-1抗体联用,结果显示联合疗法不仅能显著抑制原发与远处转移肿瘤的生长,还能进一步重塑免疫微环境,增强系统抗肿瘤免疫应答。转录组学分析证实,该治疗可上调多条免疫相关信号通路,包括Toll样受体通路、T细胞受体通路及干扰素应答通路,从分子层面揭示了其免疫激活机制。
综上所述,该研究成功构建了一种多功能脂质纳米平台,通过光热治疗与免疫佐剂的协同作用,有效激活局部及系统抗肿瘤免疫,抑制膀胱癌进展。该策略不仅为膀胱癌的联合免疫治疗提供了新思路,也为其他实体肿瘤的免疫疗法开发提供了重要参考。
参考消息:
DOI: 10.1021/acsnano.4c17444
- 上一款: IF:10.2!双响应水凝胶新突破:温和光热
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿