Theranostics | 可编程分子显微镜:CRISPR/Cas 荧光探针革新了时空基因组成像。
QQ学术交流群:1092348845
详细介绍
生物影像技术通过可视化解析生物分子、细胞和组织的时空动态,从而获得关于基因调控、疾病机制和药物代谢的重要见解。基于 CRISPR/Cas 的荧光探针将 CRISPR 从“遗传剪刀”转变为“分子显微镜”,成为活体系统中分子事件原位解码的必不可少工具。其高核酸特异性使 CRISPR/Cas 成为动态监测活细胞和体内基因组和转录组事件的关键技术。本研究系统地概述了主流 CRISPR/Cas 荧光探针用于生物成像的设计策略和功能机制,涵盖五大类:荧光蛋白、合成染料、智能门控探针、纳米材料和多模态集成探针。全面分析了实现高灵敏度靶向成像、有效信号放大和精确传递控制的最新进展与持续挑战,包括其在复杂生物环境中的优势、局限性及适应性分析。基于体内递送系统的突破,多样化的载体展现出显著潜力,能够提升 CRISPR/Cas 的运输效率、改善组织穿透性,并实现时空可控释放。持续的创新推动 CRISPR/Cas 成像平台朝着更高的灵敏度、增强的生物相容性和多功能集成性发展,从而促进基因编辑与分子诊断的融合与广泛应用。

该研究以题为“Programmable molecular microscopy: CRISPR/Cas fluorescent probes revolutionizing spatiotemporal genomic imaging.”发表在Theranostics上。
 CRISPR/Cas 系统从基本原理到生物成像应用的功能转化示意图。它涵盖了四种代表性核酸酶:Cas9、Cas12、Cas13 和 Cas14。由于它们具备特异性识别和切割能力,不同的 Cas 蛋白已逐步被改造成可视化探针,使 DNA、RNA 和染色质结构的动态成像成为可能。这一进展极大地拓展了 CRISPR 技术在基因调控、体外诊断和生物成像中的应用价值。
CRISPR/Cas 系统从基本原理到生物成像应用的功能转化示意图。它涵盖了四种代表性核酸酶:Cas9、Cas12、Cas13 和 Cas14。由于它们具备特异性识别和切割能力,不同的 Cas 蛋白已逐步被改造成可视化探针,使 DNA、RNA 和染色质结构的动态成像成为可能。这一进展极大地拓展了 CRISPR 技术在基因调控、体外诊断和生物成像中的应用价值。
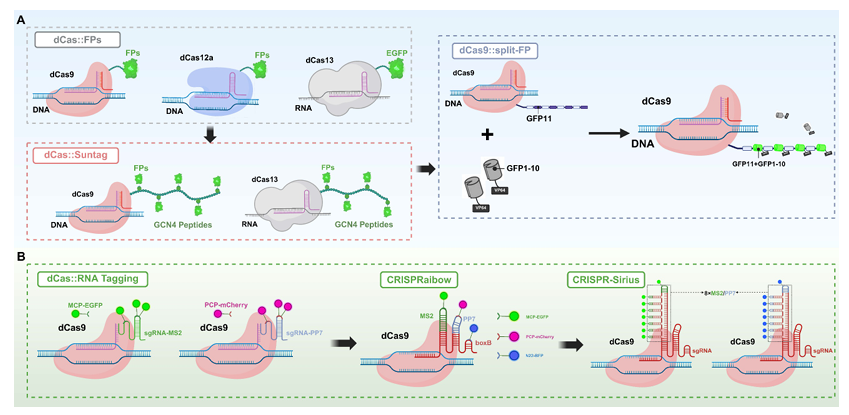
基于FPs的成像策略由CRISPR/Cas系统实现。该图展示了两种将FPs整合到基于CRISPR的生物成像平台中的主要策略,突出它们的作用机制和标记方案。(A) Cas蛋白直接融合FP:荧光蛋白直接与催化失活的dCas变体融合,以实现对特定DNA或RNA靶标的可视化。这包括单个FP融合以及增强系统如SunTag,其中多个GCN4肽招募多个FP以增强信号。另一种方法是分裂FP策略,其中dCas9与GFP11片段融合,并通过单独表达的GFP1-10域进行互补,从而在靶基因位点有条件地组装完整荧光信号。(B) 通过sgRNA支架进行FP标记:该策略利用包含RNA适体环的工程化sgRNA,招募FP偶联的RNA结合蛋白。CRISPRainbow系统采用此方法,通过在单个sgRNA支架中组合不同的适体-蛋白对,实现基因组位点的多色标记。在此基础上,CRISPR-Sirius系统在sgRNA中引入多个串联的适体副本(MS2/PP7),通过在靶位点招募更多FP标记蛋白来增强荧光强度。综合来看,这些系统使得利用单个dCas9蛋白可以实现多重化、动态且高信号的染色质结构成像。FPs:荧光蛋白;sgRNA:单导RNA。
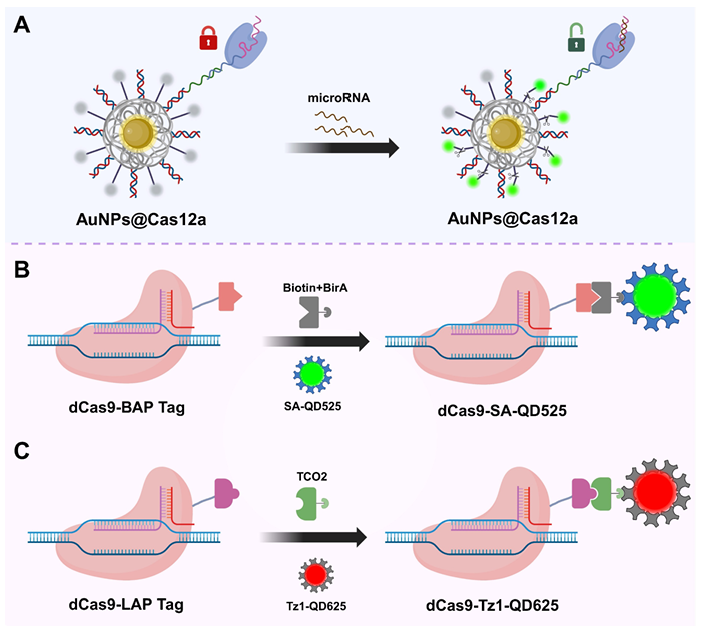
使用纳米探针进行CRISPR/Cas生物成像的示意图。(A) 用于Cas系统传递的金纳米颗粒(AuNPs)[49]。AuNPs表面可以高密度功能化修饰有二硫键的硫醇化寡核苷酸,从而实现sgRNA或荧光探针的多价锚定,同时高效淬灭荧光信号。这些特性使AuNPs能够作为Cas12a系统装载和激活的“开关”;(B) 基于LplA的量子点标记CRISPR系统(8)。在该方法中,dCas9与硫辛酸受体肽(LAP)融合,在LplA存在下与TCO2连接。随后Tz1-QD与TCO2共轭,形成用于靶DNA可视化的dCas9标记的四嗪-量子点复合物;(C) 基于生物素-链霉亲和素系统的量子点标记策略。在该方法中,dCas9与BAP标签融合,并通过生物素连接酶BirA进行生物素化。随后SA-QD与生物素化的dCas9结合,实现靶DNA的荧光标记与可视化。AuNPs:金纳米颗粒;SA-QD:链霉亲和素连接量子点;QDs:量子点;LplA:硫辛酸连接酶;BAP-tag:生物素受体肽;TCO2:反式环辛烯;Tz1-QD:四嗪修饰量子点。
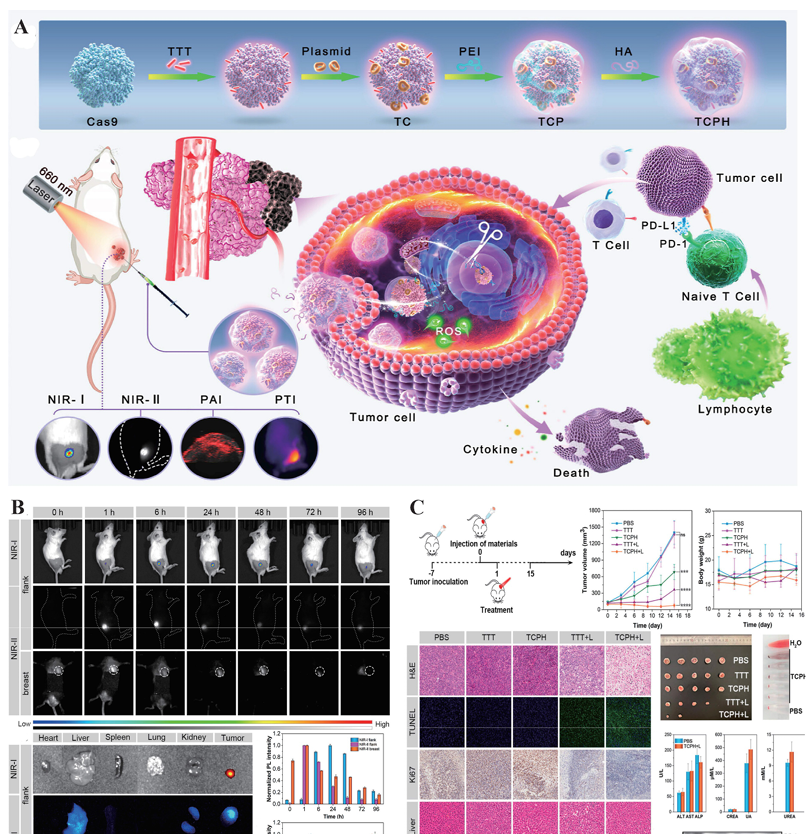
多模态探针。(A) 使用分步组装策略构建TCPH纳米颗粒(NPs)的示意图。(B) 4T1肿瘤负荷的BALB/c小鼠在肿瘤内注射TCPH后不同时间点的体内和离体近红外I/近红外II荧光成像(FLI),显示肿瘤和主要器官。同时展示了肿瘤和器官相应的归一化光致发光(PL)强度。(C) 在单侧皮下4T1肿瘤模型中评估TCPH的抗肿瘤效果,包括体内PDT/PTT/免疫治疗过程、肿瘤生长和体重监测、肿瘤和主要器官的组织学分析(H&E、TUNEL、Ki67)、肿瘤切除、溶血测试、肝肾功能测定以及代表性的西方印迹(WB)图谱。经许可改编自[10],版权2024年归美国化学学会所有。
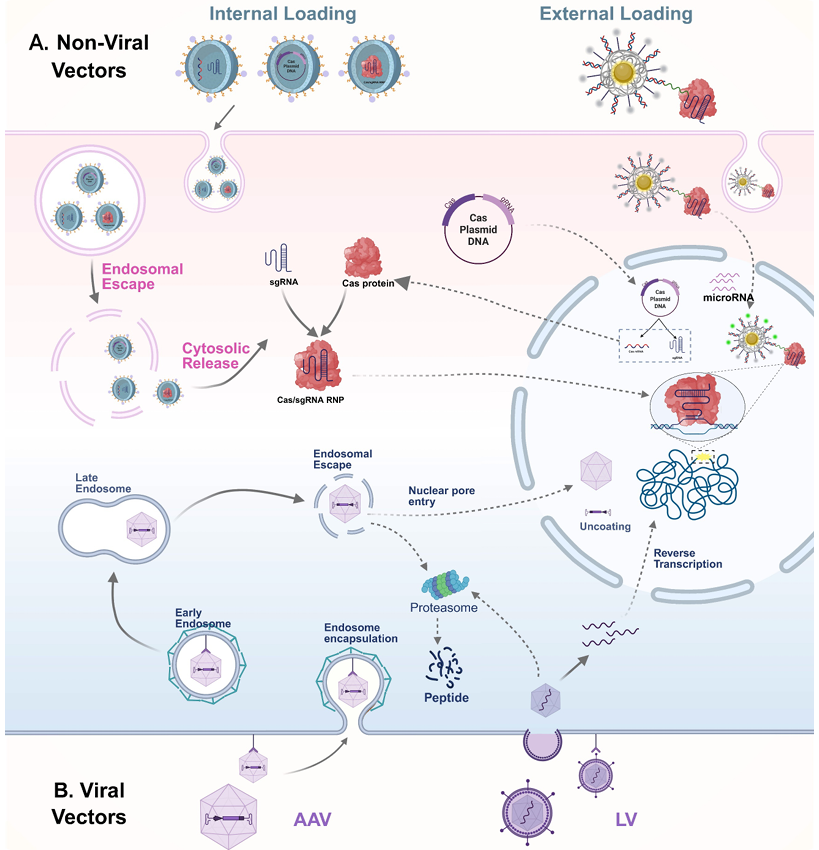
在体内递送CRISPR/Cas系统时,通常使用病毒载体和非病毒载体,两者各有不同的机制和应用优势。在病毒载体(B)中,AAV和LV是使用最广泛的。它们都能结合靶细胞表面的特定受体以启动感染,并随后被内吞。进入细胞后,AAV能够从内体中逃逸并穿过核膜进入细胞核,尽管在细胞质中也可能发生蛋白酶体介导的衣壳降解。相比之下,慢病毒直接与细胞膜融合,将其RNA基因组释放到细胞质中,在那里进行反转录生成双链互补DNA,然后整合到宿主基因组中,从而实现Cas系统的长期表达。与病毒载体相比,非病毒递送系统提供了更高的生物安全性和更大的货物形式多样性,包括质粒DNA、mRNA和预组装的RNPs(A)。这些系统可以设计为内部或外部装载货物。通常,非病毒载体通过内吞进入细胞,并必须从内体中逃逸,将货物释放到细胞质中。根据递送的形式,质粒DNA需要达到细胞核进行转录,mRNA在细胞质中被翻译生成Cas蛋白,而RNPs可以直接转运进入细胞核以靶向特定DNA序列。AAV:腺相关病毒;CRISPR:成簇规律间隔短回文重复序列;Cas:CRISPR相关蛋白;RNP:核糖核蛋白复合物;LV:慢病毒。
总结
《自然·通讯》近日发表综述,系统梳理了CRISPR/Cas技术在分子显微成像中的最新进展。该技术已从“基因剪刀”发展为“分子显微镜”,通过结合荧光蛋白、合成染料、智能门控探针、纳米材料与多模态平台,实现了对活细胞及活体内核酸的动态、高分辨率成像。其中,Cas9已发展成模块化成像平台,Cas12具备信号放大能力,Cas13专注于RNA实时追踪,而超小型的Cas14则为体内递送与微环境成像带来新可能。
目前,该领域正朝着更高灵敏度、更低背景噪声、更智能可控的方向发展,并通过与纳米递送系统、光控开关、逻辑门探针等多技术融合,不断提升其在复杂生物环境中的成像性能与临床应用潜力。未来,随着人工智能辅助设计、多模态成像整合与体内递送系统的持续优化,CRISPR成像技术有望在疾病早期诊断、基因调控可视化及精准治疗评估中发挥关键作用。
参考文献:
DOI: 10.7150/thno.125565
- 上一款: IF :20.3!注射型水凝胶新突破:协同化
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿