Advanced Materials | 新型抗菌纳米细菌素:提取乳酸细菌,自组装并增强以增强抗菌活性
QQ学术交流群:1092348845
详细介绍
随着抗菌素耐药性成为全球严重健康威胁,食品级细菌素(一种抗菌肽(AMPs)提供了有前景的新疗法,但因稳定性差和水溶性低而受限。为此,我们设计了一种无载体自组装策略:对发酵食品中乳酸菌产生的新型细菌素进行了改造,增强其疏水性,使得在 TSB、LB 和 MH 培养基中自发生成纳米抗菌菌素(NAMBs)。这些 NAMBs 具有更广泛的抗菌作用,对革兰氏阳性和革兰氏阴性病原体(包括李斯特菌单核细胞增生、鲍曼不动杆菌和副溶血弧菌)均具增强效力,表现为体外抑制剂浓度显著降低,体内感染小鼠治疗效果更优。机制性研究显示细胞包膜代谢的有针对性干扰:在单核细胞增生中,NAMBs 强化肽聚糖层,同时减少壁面的二酸和脂酰胆酸,损害碳水化合物代谢和膜运输;在鲍曼单胞菌中,它们降低脂肪酸合成、磷脂组成紊乱,削弱脂多糖完整性,最终导致膜不稳定和细胞死亡。这些双重作用——扰乱代谢过程和重塑细菌细胞壁或膜——凸显了 NAMBs 的多功能性。我们的无载体自组装方法克服了 AMP 的稳定性和溶解度限制,为下一代抗菌治疗铺平了道路。
 该研究以题为“Novel Antimicrobial Nano Bacteriocin: Lactic Acid Bacteria-Derived, Self-Assembled, and Enhanced for Superior Antimicrobial Activity”发表在Advanced Materials上。
该研究以题为“Novel Antimicrobial Nano Bacteriocin: Lactic Acid Bacteria-Derived, Self-Assembled, and Enhanced for Superior Antimicrobial Activity”发表在Advanced Materials上。
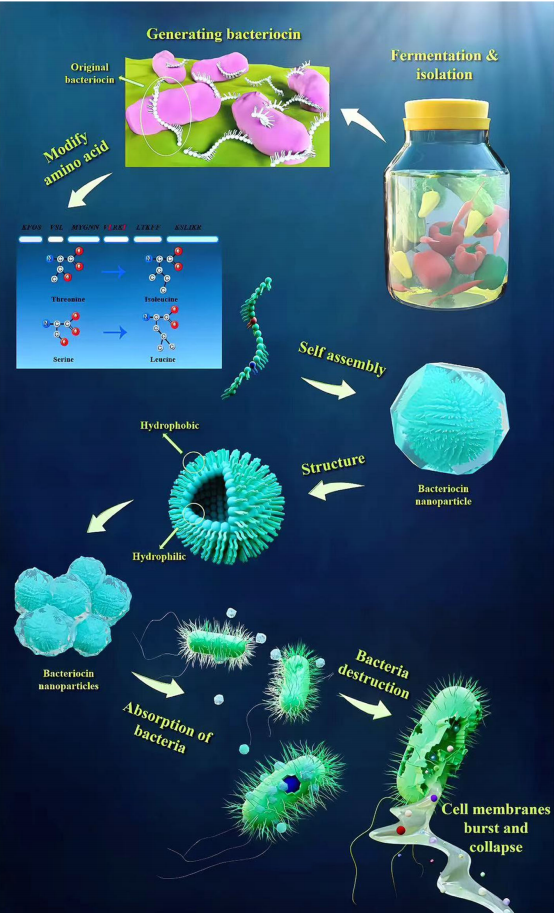
示意图概述。乳酸菌(LAB)在发酵食品保泰(Paocai)中产生的细菌素概述涵盖多个关键方面,包括世代、修饰、结构、自组装成纳米颗粒以及细菌素纳米颗粒的抗菌机制。
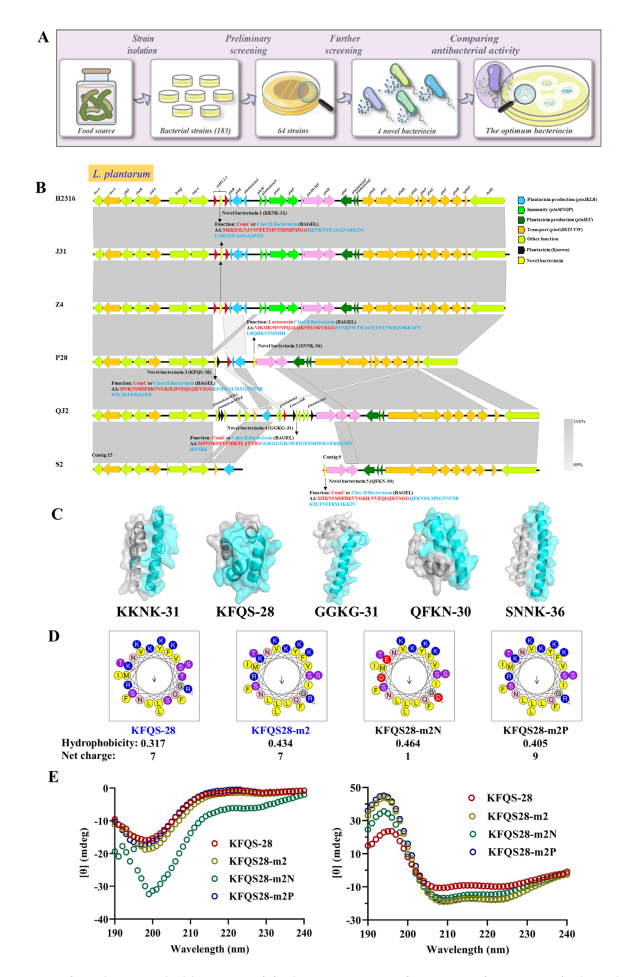
新型抗菌细菌素的发现。(A) 从发酵食品中的乳酸菌(LAB)到筛选抗菌细菌素的概念流程;(B) 通过基因组测序鉴定具有潜在抗菌活性的新型细菌素;(C) 采用AlphaFold3对五种新型细菌素进行结构预测;(D) 通过替换现有氨基酸序列生成三种具有不同疏水性和净电荷的细菌素;(E) 四种细菌素在水溶液(左)和10 mM SDS溶液(右)中的圆二色光谱分析
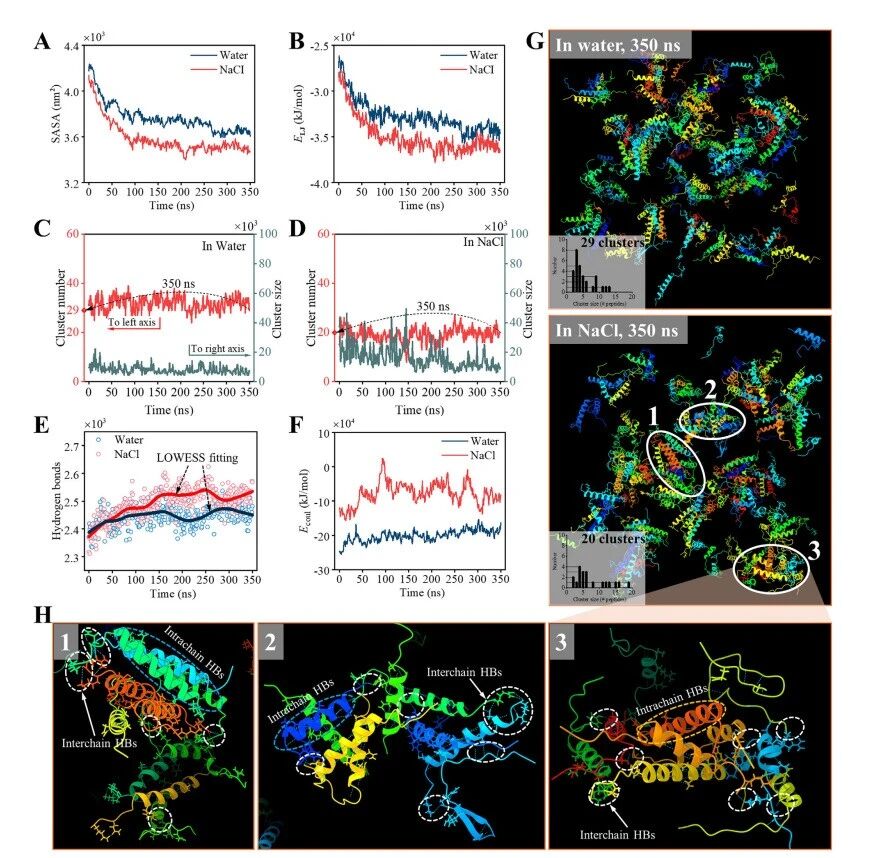
通过0-350纳秒分子动力学模拟对肽聚集的动力学、热力学及结构分析,研究对象包括水溶液和氯化钠溶液。(A) 溶剂可及表面积(SASA)演变。(B) Lennard-Jones势能(ELJ)分布。(C) 聚集簇数量及(D) 大小分布(通过每簇原子计数测量)。(E) 氢键形成动力学。(F) 库仑相互作用能(Ecoul)分布。(G) 水溶液(上图)和氯化钠溶液(下图)中350纳秒时的最终肽聚集结构,插图显示聚集体大小分布(每簇肽计数)。水溶液和氯化钠溶液分别形成29个和20个不同大小的聚集体。几乎所有肽在聚集过程中保持 α 螺旋构象。(H) 图G下图区域1-3的放大视图,突出显示关键的链间及链内氢键(虚线圆圈标示),这些氢键涉及驱动自组装的N端和C端残基。
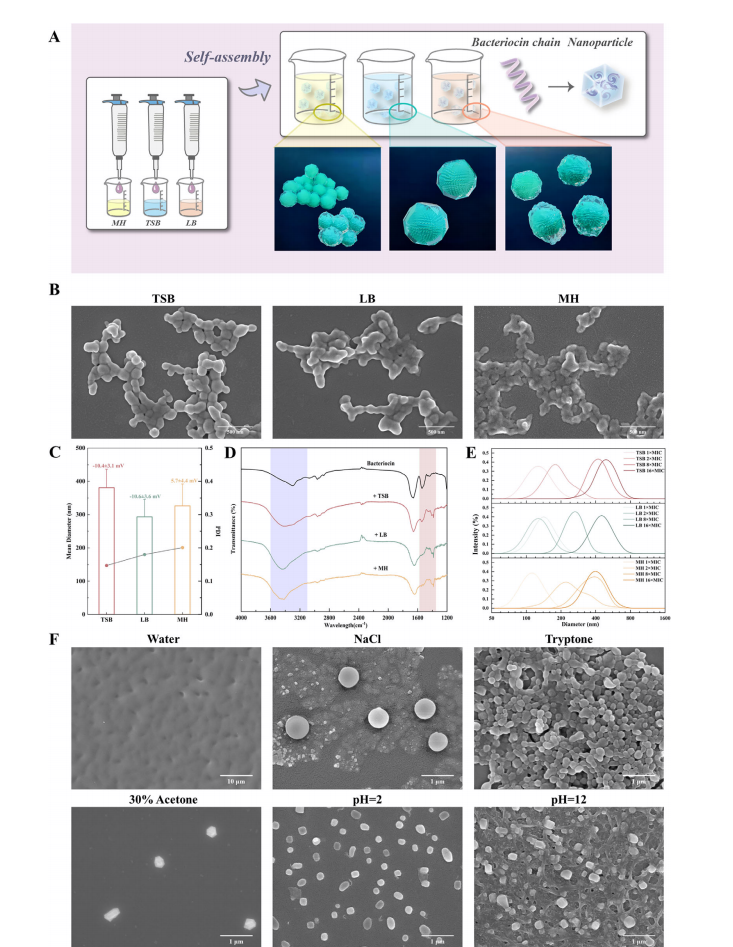
新型抗菌细菌素的自组装纳米颗粒。(A) NAMBs在TSB、LB和MH肉汤中的自组装概念;(B)不同肉汤介质中NAMBs自组装的SEM图像;(C)三种不同肉汤获得的NAMBs表征:粒径统计与zeta电位(8×MIC);(D)FT-IR透射率(8×MIC);(E)不同细菌素浓度下的粒径分布;(F)8×MIC(64 µm)浓度NAMBs在不同肉汤及体系潜在关键组分中自组装的SEM图像。
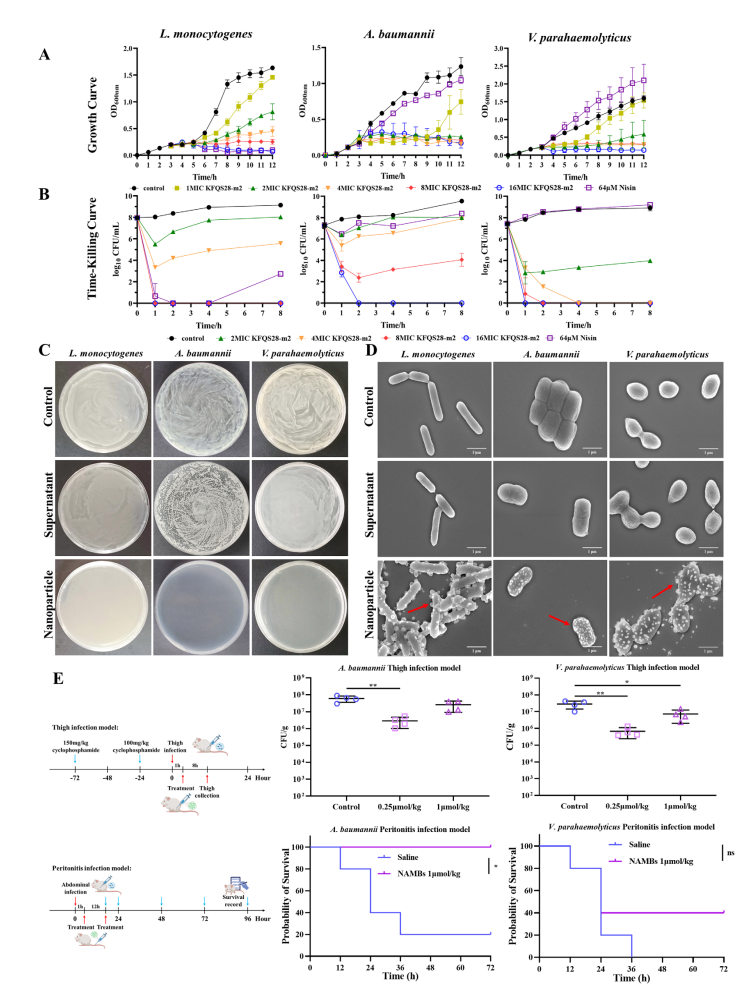
自组装抗菌细菌素纳米颗粒的抗菌活性。(A) 细菌素KFQS28-m2与乳酸链球菌素对单核细胞增生李斯特菌、鲍曼不动杆菌和副溶血性弧菌的生长曲线及(B) 杀菌时间曲线对比;(C) 离心后不同培养基中细菌素自组装产物的上清液与纳米颗粒的抗菌效果;(D) 离心后不同培养基中细菌素自组装产物的上清液与纳米颗粒对不同细菌的结合效果扫描电镜图像(红色箭头指示纳米颗粒与细胞包膜的结合);(E) 小鼠大腿感染和腹部感染模型经NAMBs处理后的对比(**p < 0.01;*p < 0.05)。
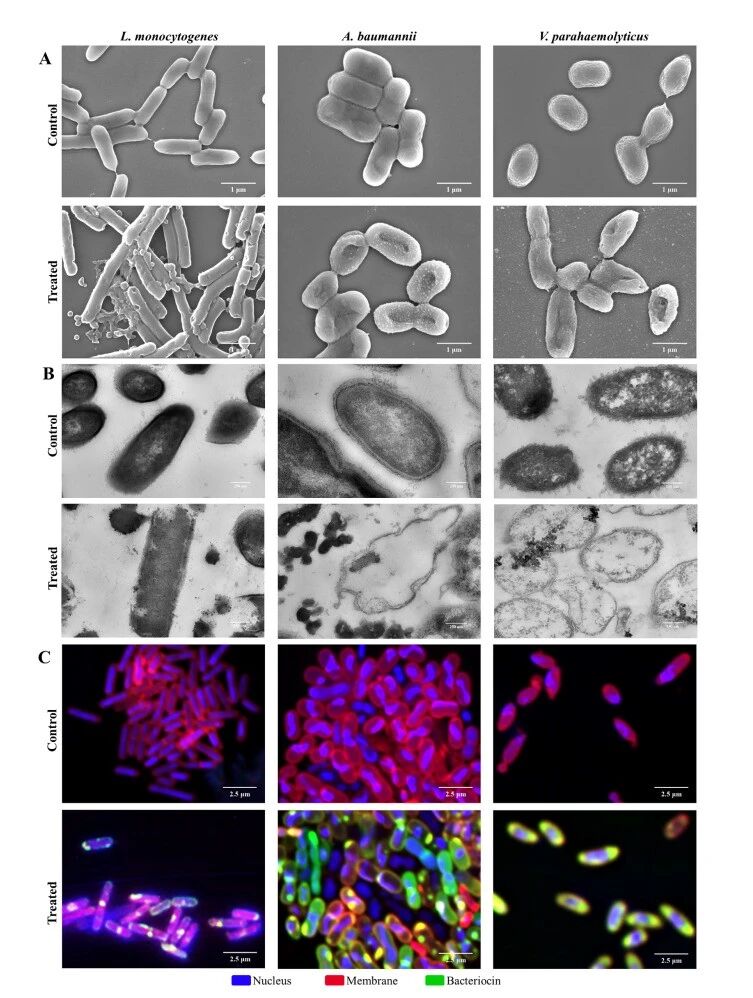
自组装抗菌细菌素纳米颗粒的抗菌活性机制。(A)NAMBs处理导致三种细菌膜损伤致死的扫描电镜(SEM)图像;(B)三种细菌超微结构变化的透射电镜(TEM)图像;(C)NAMBs与三种细菌相互作用作用位点的 CLSM 图像。
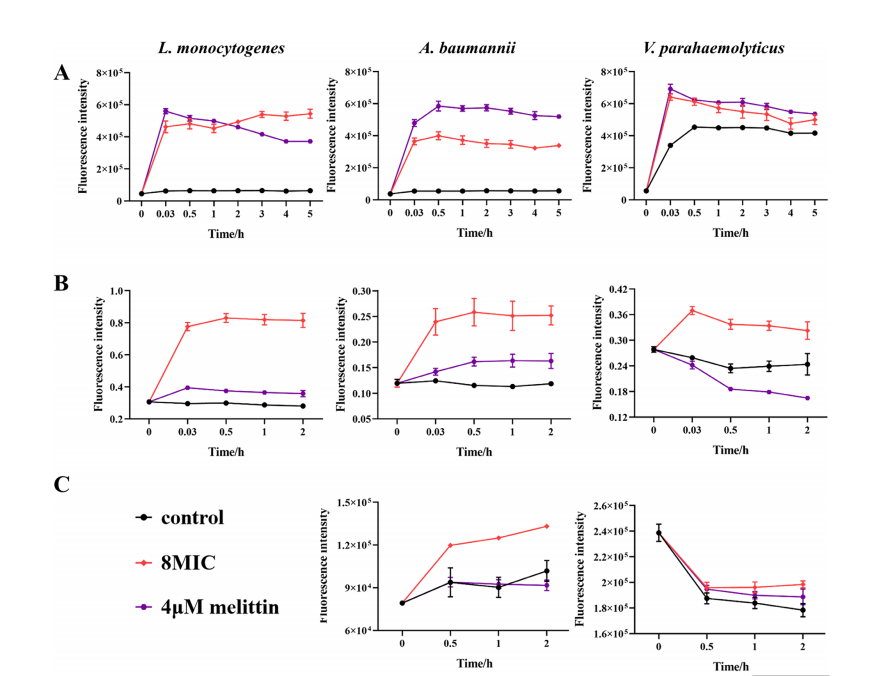
与4 µm 蜂毒肽作为阳性对照相比,经8×MIC浓度NAMBs处理后,(A)整体膜、(B)内膜及(C)外膜的通透性均发生改变。
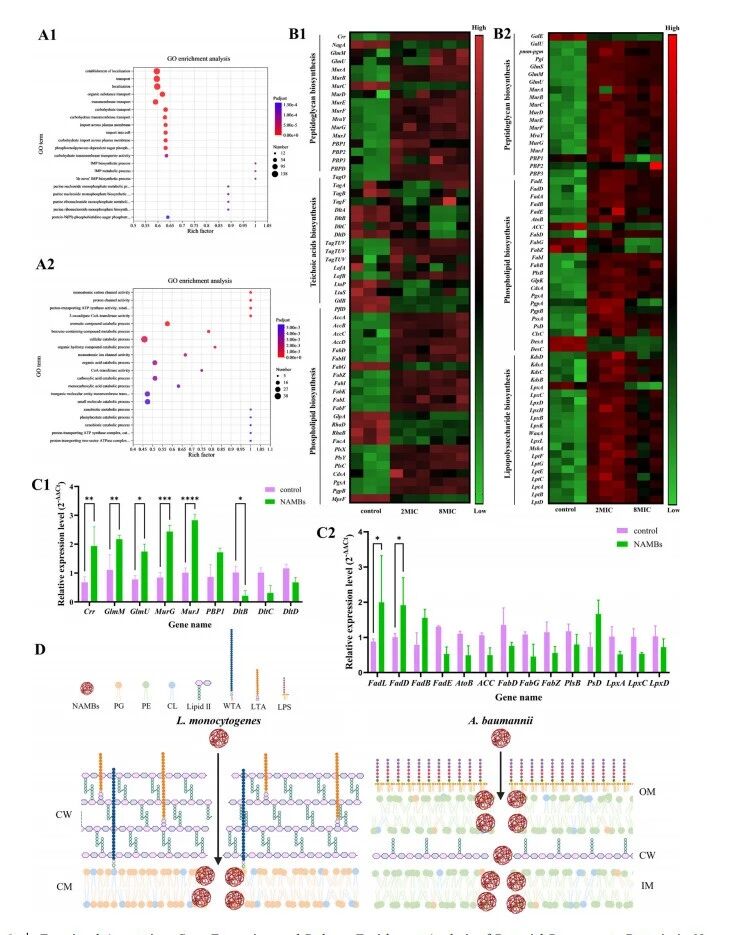
细菌对细菌素纳米颗粒处理反应的功能注释、基因表达及通路富集分析。(A) 单核细胞增生李斯特菌(A1)和鲍曼不动杆菌(A2)经8×MIC NAMBs处理后的GO富集分析;(B) 单核细胞增生李斯特菌(B1)和鲍曼不动杆菌(B2)细胞包膜组分生物合成相关基因的热图;(C) 单核细胞增生李斯特菌(C1)和鲍曼不动杆菌(C2)细胞壁基因经0.5小时8×MIC NAMBs处理后的RT-qPCR分析;(D) NAMBs对单核细胞增生李斯特菌和鲍曼不动杆菌细胞包膜的作用机制,CW-细胞壁,CM-细胞膜,IM-内膜,OM-外膜,PG-磷脂酰甘油,PE-磷脂酰乙醇胺,CL-心磷脂,WTA-壁磷壁酸,LTA-脂磷壁酸,LPS-脂多糖。
总结
面对日益严峻的抗生素耐药性问题,开发新型抗菌策略迫在眉睫。近期,一项发表在《Advanced Materials》的研究提供了一种极具前景的解决方案:研究人员从中国传统发酵食品“泡菜”中分离的植物乳杆菌里,发现了一种全新的抗菌细菌素KFQS-28,并通过对其氨基酸序列进行精妙疏水修饰,创造出了新型变体KFQS28-m2。这种经过改造的抗菌肽能够在TSB、LB等常规培养基中快速、自发地组装成纳米颗粒,形成“无载体纳米抗菌细菌素”。
该纳米颗粒展现出广谱且高效的抗菌活性,不仅能有效抑制单核细胞增生李斯特氏菌等革兰氏阳性菌,对鲍曼不动杆菌和副溶血性弧菌等棘手的革兰氏阴性菌同样具有强大的杀灭作用。研究表明,这些纳米颗粒主要通过靶向破坏细菌细胞包膜来发挥作用:针对革兰氏阳性菌,它们能加固其肽聚糖层,同时削弱磷壁酸,扰乱其碳水化合物代谢;针对革兰氏阴性菌,则下调脂肪酸合成,扰乱磷脂组成并削弱脂多糖完整性,最终导致细胞膜崩解。动物感染模型结果进一步证实,该纳米抗菌剂能显著降低小鼠感染部位的细菌载量,并有效提高感染后的生存率。这种基于食物源益生菌、通过自组装形成的纳米抗菌平台,为应对多重耐药菌感染提供了高效、安全且可持续的新思路。
参考文献:
DOI: 10.1002/adma.202511782
- 上一款: Bioactive Materials |
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿