Nature Nanotechnology | 信使 RNA 脂质纳米颗粒的时空靶向子宫内膜,用于生殖障碍治疗
QQ学术交流群:1092348845
详细介绍
子宫内膜功能障碍(子宫内膜)会影响胚胎着床并降低怀孕率。宫内给药细胞因子已被证明有潜力改善子宫内膜功能,但由于靶向不佳和系统性副作用限制性,这一方法受到挑战。本文提出一种将治疗性信使 RNA 引入子宫内膜以治疗生殖障碍的策略。mRNA 被加载到配体共軛脂质纳米颗粒(LNP)中,使得在着床窗口期间与子宫内膜表面时间过度表达的整合素受体实现多价相互作用。将靶向配体直接结合到脂质成分,增强了宫内输注后子宫内膜蛋白的表达,并减少肝脏和脾脏的全身表达。单次颗粒细胞-巨噬细胞集落刺激因子(GM-CSF)mRNA 负载 LNP 的输注可维持局部蛋白表达数小时,减少 GM-CSF 全身暴露。在子宫内膜损伤小鼠模型中,GM-CSF mRNA 负载 LNP 提高了胚胎着床率,优于重组 GM-CSF。我们的策略展示了使用 mRNA 改善生育结果的有效性。

在生殖医学领域,子宫内膜功能障碍是导致胚胎着床失败和妊娠率下降的重要原因之一。尽管宫腔内直接给予细胞因子等治疗手段显示出改善子宫内膜容受性的潜力,但由于靶向性不足和全身性副作用等问题,其临床应用受到限制。近期,一项发表于《自然·纳米技术》的研究提出了一种基于信使RNA(mRNA)脂质纳米颗粒(LNP)的新型靶向治疗策略,通过时空特异性递送,为子宫内膜相关生殖障碍的治疗提供了新思路。
该研究团队设计了一种靶向修饰的脂质纳米颗粒,将含有RGD肽的配体直接连接于脂质成分上,使其能够与子宫内膜着床窗口期高表达的整合素受体发生多价相互作用。这种被称为“BLOC”的功能化策略,不仅显著提高了mRNA在子宫内膜的递送效率和蛋白表达水平,还意外地降低了肝脏、脾脏等非靶器官的系统性表达。实验表明,在着床窗口期通过宫腔单次灌注携带荧光素酶报告基因的靶向LNP,子宫内的荧光素酶表达较非靶向LNP提高了3.9倍,而在肝脏和脾脏中的表达则分别降低了450倍和65倍,显示出优异的组织选择性。
进一步研究发现,该靶向系统能够将mRNA有效递送至子宫内膜的腔上皮、腺体及间质等多种细胞类型,并实现编码蛋白的局部持续表达。研究以粒细胞-巨噬细胞集落刺激因子(GM-CSF)为治疗模型,发现装载GM-CSF mRNA的靶向LNP在宫腔灌注后,可在子宫局部诱导产生高水平的GM-CSF蛋白,表达时间可持续至24小时,且子宫局部药物暴露量相较于血浆高出50倍以上,系统性暴露则比直接灌注重组GM-CSF蛋白降低了60倍,有效避免了因全身性分布带来的潜在副作用。
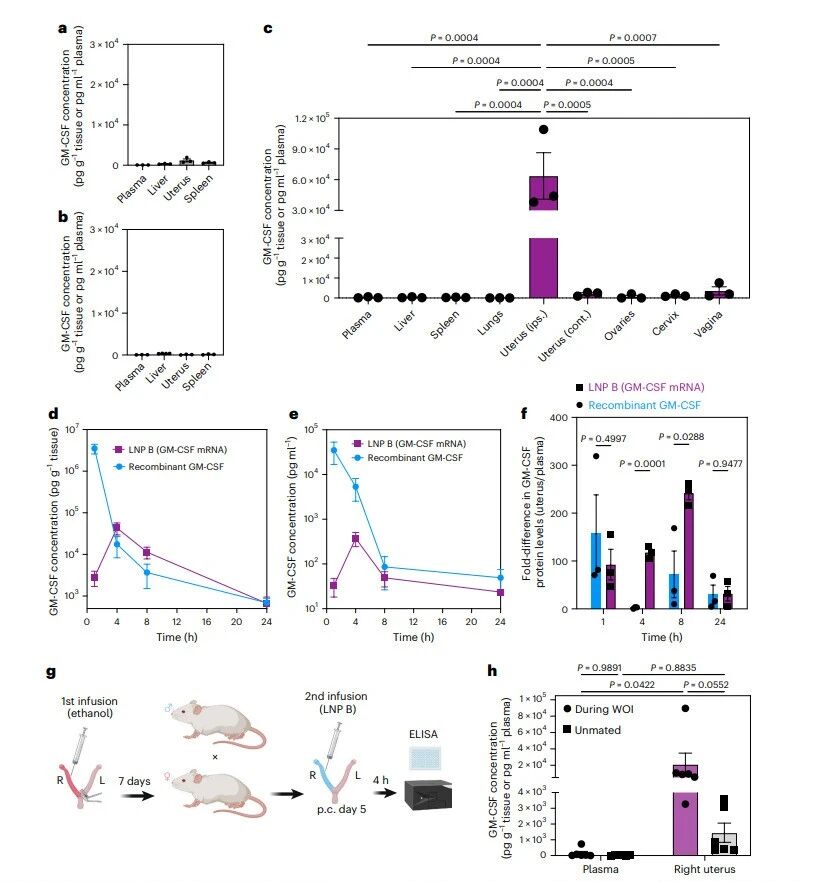
GM-CSF表达的生物分布与动力学
为了验证其治疗潜力,研究团队建立了小鼠子宫内膜损伤模型。结果显示,单次宫腔灌注GM-CSF mRNA-LNP能显著恢复损伤子宫角的胚胎着床数量,效果优于同等剂量的重组GM-CSF蛋白治疗,且未观察到明显的急性毒性反应。这一结果证实了该靶向递送系统在修复子宫内膜、改善生育结局方面的有效性和安全性。
综上所述,这项研究成功开发了一种时空靶向的mRNA-LNP宫腔递送平台,通过巧妙的配体修饰和制剂设计,实现了子宫内膜的高效、局部化治疗,同时最大限度减少了脱靶效应。该策略不仅为薄型子宫内膜、反复种植失败等生殖障碍提供了新的治疗方案,也为子宫内膜异位症、子宫内膜癌等其它妇科疾病的靶向治疗开辟了新的路径,展现出良好的临床转化前景。
参考消息:
DOI: 10.1038/s41565-025-02108-7
- 上一款: Theranostics | 从纳米标签到精
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿