Advanced Materials | 利用条码 mRNA 进行高通量体内筛选,识别具有肝外嗜滋性的脂质纳米颗粒,用于原位免疫工程
QQ学术交流群:1092348845
详细介绍
对 mRNA 疫苗和治疗药物的兴趣持续增长。虽然对传染病免疫有效,但用于其他 mRNA 递送应用的脂质纳米颗粒(LNP)制剂存在非靶向积累、免疫转染差和反应原性,限制了其在免疫工程中的应用。新 mRNA 低密度核酸酶的开发因依赖低频测量而历史上通量较低,严重受限于新 mRNA 的开发。我们开发了基于条形码 mRNA(b-mRNA)的高通量体内 mRNA LNP 筛选平台。利用该 b-mRNA 筛选平台同时评估 122 种 LNP,我们识别出具备高效肝外转染能力的新型 LNP 制剂。我们评估了一种用于原位免疫调节的先导 LNP 候选物,在黑色素瘤同源小鼠模型中表现突出,结果显示与采用金标准 mRNA LNP 制剂治疗的小鼠相比,肿瘤负荷显著减少并延长了生存期。我们采用新型生化表征技术,以单颗粒分辨率分析纳米颗粒蛋白冠状形成,深入了解蛋白质吸附对肝脏和脾脏转染的影响。我们的研究结果共同展示了先进 LNP 筛选和表征技术在开发下一代 mRNA 免疫工程用 LNPs 中的价值。

随着mRNA疫苗在应对新冠疫情中取得的巨大成功,基于脂质纳米粒(LNP)的mRNA递送技术已成为生物医药领域的前沿焦点。然而,目前临床应用的LNP普遍存在肝脏非特异性富集、对免疫细胞转染效率低以及潜在反应原性等问题,极大地限制了其在癌症免疫治疗等需要对特定免疫细胞进行原位工程化改造领域的应用。传统的基于报告基因(如荧光素酶或荧光蛋白)的LNP筛选方法通量低、周期长,已成为开发新一代递送系统的关键瓶颈。为此,研究人员迫切需要一种能够直接在活体内高通量、精准评估大量LNP递送效能的革命性筛选平台。
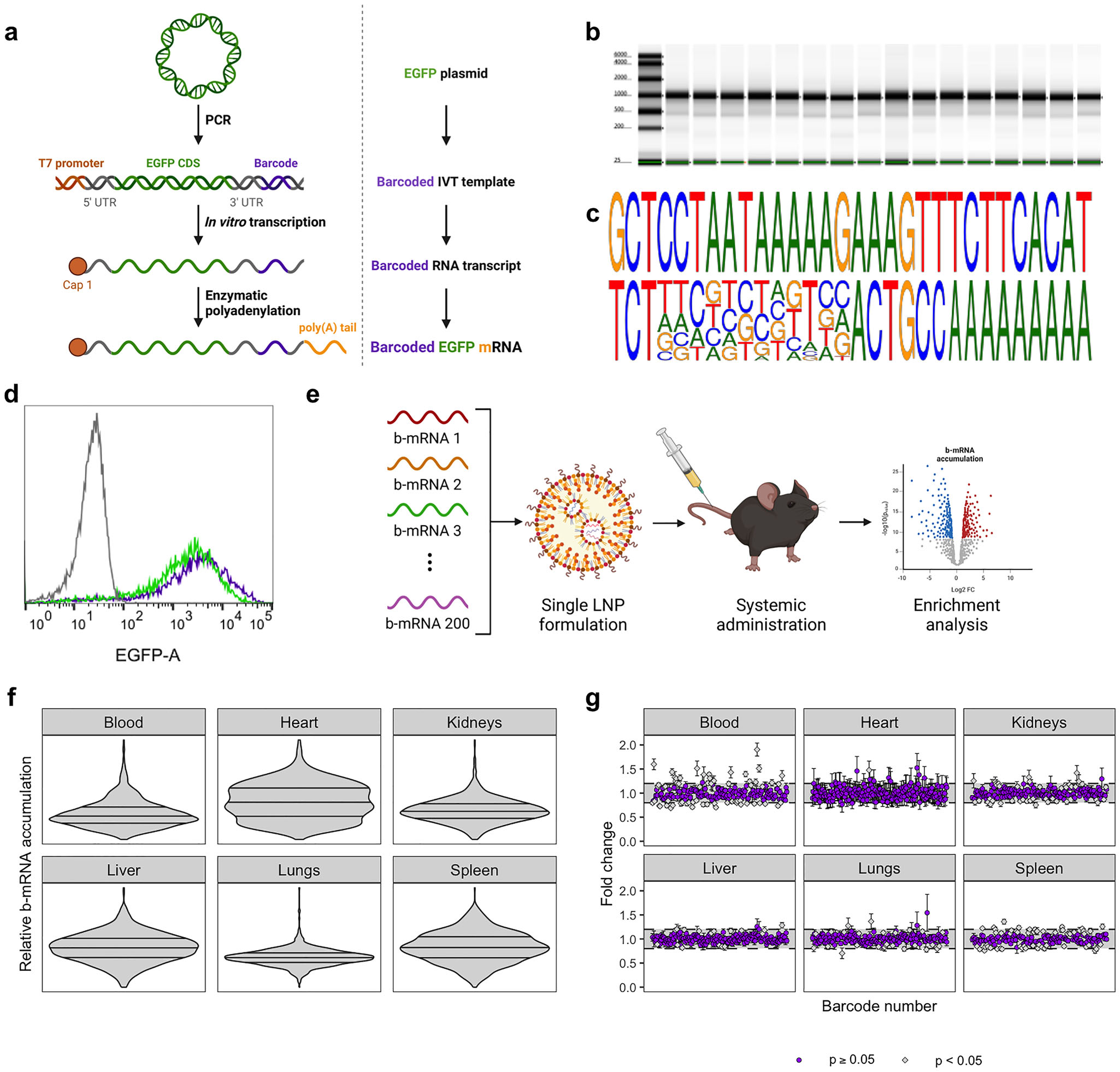
宾夕法尼亚大学Michael J. Mitchell团队近期在《先进材料》上报告了一项重要进展:他们成功开发了一种基于条形码mRNA(b-mRNA)的高通量体内筛选平台,并利用该平台快速鉴定出具有高效肝外靶向能力的新型LNP,显著提升了原位免疫工程化的效率。该技术的核心在于,研究者设计了包含200个12核苷酸条形码序列的mRNA文库,这些条形码经过严格的误差校正优化,确保在二代测序中能够被准确识别与区分。所有条形码mRNA均编码相同的增强型绿色荧光蛋白(EGFP),但其独特的“分子身份证”——条形码序列不同。通过将不同条形码mRNA封装至不同的LNP中,并将这122种LNP组成的混合库一次性静脉注射至小鼠体内,研究者便可借助后续的组织分离、细胞分选及高通量测序,同时追踪每一种LNP在血液循环、肝脏、脾脏、肺脏等不同器官以及各类免疫细胞中的分布与递送情况。
研究者构建了一个包含133种不同可电离脂质的庞大LNP库,其中既包含基于“即插即用”策略合成的120种新型可生物降解脂质,也涵盖了C12-200、SM-102、ALC-0315等作为对照的行业标准脂质。在野生型C57BL/6小鼠和载脂蛋白E敲除(APOE⁻/⁻)小鼠中进行高通量筛选后,研究团队鉴定出多个在肝脏和肝外组织中均表现出优异mRNA递送能力的候选LNP。值得注意的是,在缺乏ApoE介导的肝脏摄取途径的APOE⁻/⁻小鼠中,更多具有独特靶向潜力的LNP脱颖而出,这提示部分新型LNP可能通过不依赖于ApoE/LDLR通路的机制实现递送,为开发非肝靶向制剂提供了新思路。
通过低通量验证实验,研究者重点评估了数个先导LNP在组织和细胞水平的实际转染能力。令人振奋的是,LNP 112 在脾脏中展现出极强的mRNA表达信号,而肝脏信号极弱,被明确归类为“脾靶向”LNP。单细胞水平的流式细胞术分析进一步证实,LNP 112虽在脾脏巨噬细胞和树突状细胞中的积累量并非最高,却能在这两类关键的抗原提呈细胞中实现高效的EGFP蛋白表达,这对于激活适应性免疫应答至关重要。相比之下,LNP 97 则表现出极强的肝细胞转染能力,近80%的肝细胞被成功转染,提示其在肝脏疾病治疗或利用肝脏耐受环境治疗自身免疫病方面具有巨大潜力。
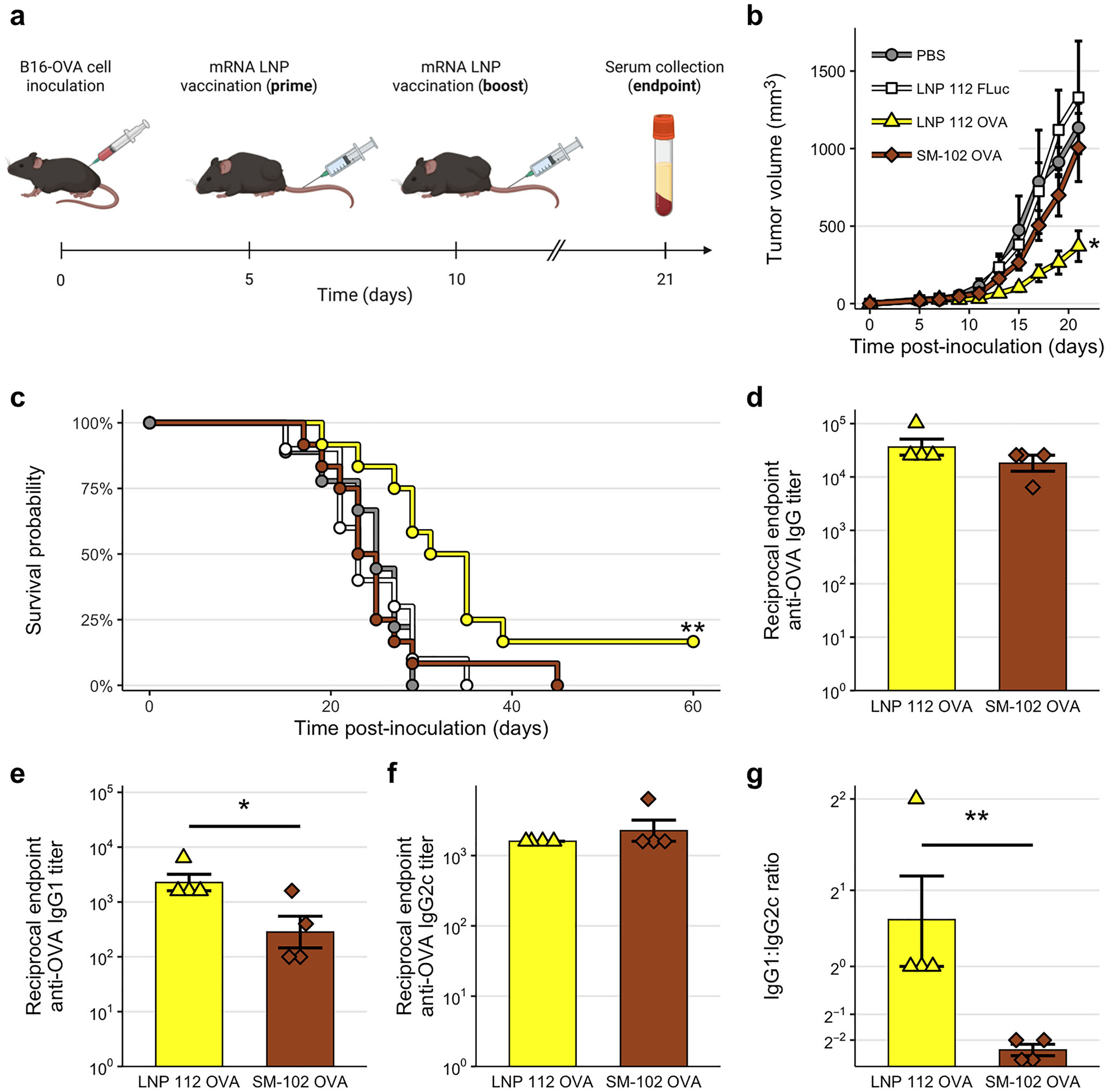
为验证筛选出的脾靶向LNP在肿瘤免疫治疗中的应用价值,研究团队在B16-OVA黑色素瘤同系小鼠模型中评估了LNP 112作为癌症疫苗载体的疗效。与封装无关基因(FLuc)的对照组,以及封装相同卵清蛋白(OVA)抗原mRNA但采用临床标准脂质SM-102的LNP对照组相比,封装了OVA mRNA的LNP 112治疗组 展现了最强的抗肿瘤效果:肿瘤负荷显著降低,小鼠中位生存期延长至31天,甚至有两只小鼠的肿瘤在加强免疫后完全消退。对抗体反应的深入分析发现,LNP 112诱导产生了更高水平的抗原特异性IgG1抗体,提示其可能偏向于诱导辅助性T细胞2型免疫反应,这种独特的免疫应答特征可能与其卓越的抗肿瘤效果相关。
为深入探究LNP体内靶向性的决定因素,研究者创新性地开发了一种基于小颗粒流式细胞术的单颗粒蛋白冠分析方法。传统蛋白组学方法只能提供LNP群体的平均信息,而这项新技术能以单颗粒分辨率直接可视化并量化血清蛋白(如ApoE和β₂-GPI)在单个LNP表面的吸附情况。有趣的是,分析结果挑战了“ApoE吸附多则肝靶向强,β₂-GPI吸附多则脾靶向强”的简单化模型。研究发现,脾靶向性最强的LNP 112对ApoE的吸附水平较高,而肝靶向性最强的LNP 97却对β₂-GPI表现出最强的吸附能力。这表明LNP的体内命运由蛋白冠的复杂组成共同决定,可能存在最佳吸附比例或尚未发现的其他关键蛋白“辅助因子”,其背后的机制远比现有认知更为精细与复杂。
这项研究标志着mRNA-LNP开发范式的一次重要升级。所建立的b-mRNA高通量体内筛选平台,能够以前所未有的速度和精度从海量候选脂质中快速识别出具有特定组织或细胞靶向功能的先导分子。同时,单颗粒蛋白冠分析新方法为理性设计下一代LNP提供了至关重要的微观洞察。这项融合了高通量筛选、先进表征与功能验证的系统性工作,不仅加速了用于免疫工程化的新型mRNA递送载体的发现,也为未来开发用于蛋白替代疗法、基因编辑及其他免疫疗法的靶向性LNP奠定了坚实的方法学基础。随着该平台的进一步完善与应用,我们有望迎来一个能够按需定制、精准递送mRNA至体内任何目标细胞的新时代。
参考消息:
DOI: 10.1002/adma.202514370
- 上一款: Advanced Materials |&#
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿