Materials Today | 有机纳米敏化剂与 PARP 抑制协同作用,释放 STING 介导的免疫,用于低剂量放射免疫治疗
QQ学术交流群:1092348845
详细介绍
代谢重编程是恶性肿瘤的一个重要特征。谷氨酰胺作为肿瘤细胞的关键氮源,在癌症代谢中起着核心作用。肿瘤细胞通过“谷氨酰胺陷阱”机制吸收大量谷氨酰胺,以支持大分子合成、能量产生、氧化还原平衡和免疫调节。因此,靶向谷氨酰胺代谢是癌症治疗的有效策略。已经开发出靶向谷氨酰胺转运蛋白或谷氨酰胺酶的抑制剂来调节肿瘤谷氨酰胺代谢。然而,药代动力学问题和肿瘤代谢途径的复杂性限制了单靶点治疗的临床有效性。由于其独特的理化性质,纳米药物能够实现谷氨酰胺代谢调节剂的精确给药,并可与其他治疗方法相结合,以达到协同治疗效果。因此,纳米药物已成为有效调节肿瘤细胞中谷氨酰胺代谢的理想候选者。本文总结了具有谷氨酰胺调节特性的工程化纳米药物用于肿瘤治疗的最新进展,介绍了肿瘤谷氨酰胺代谢及其作用,总结了干预谷氨酰胺代谢的各种途径,并分析了该领域未来的挑战和发展前景。本文旨在强调谷氨酰胺调节纳米医学的重要性,并促进其进一步发展和临床转化。

肿瘤代谢重编程作为恶性肿瘤的关键特征,其核心环节之一是谷氨酰胺代谢的重塑。谷氨酰胺作为一种非必需氨基酸,已成为肿瘤细胞不可或缺的氮源和能量底物,通过“谷氨酰胺陷阱”机制被大量摄取,以支持大分子合成、能量供给、氧化还原平衡及免疫调节。因此,靶向谷氨酰胺代谢已成为一种极具前景的肿瘤治疗策略。然而,传统小分子抑制剂在临床上面临药代动力学欠佳、特异性不足、单靶点疗效有限以及系统性毒性等挑战。
纳米医学的兴起为这一领域带来了突破性机遇。凭借其独特的物理化学性质,纳米载体能够实现谷氨酰胺代谢调节剂的精准递送,通过增强渗透与滞留效应及主动靶向设计,显著提高药物在肿瘤组织的蓄积,并降低对正常组织的毒副作用。更为重要的是,纳米平台可将谷氨酰胺代谢干预与其他治疗模式(如化疗、光动力疗法、声动力疗法、免疫治疗等)进行智能整合,实现多机制协同治疗,从而克服肿瘤的代谢可塑性、抗氧化防御及免疫抑制等耐药屏障。
在具体应用策略上,工程化纳米药物展现出多样化的设计思路。例如,通过构建表面修饰谷氨酰胺的纳米粒,可借助肿瘤细胞高表达的ASCT2转运体实现药物的特异性靶向递送与高效内化。同时,纳米载体可包载谷氨酰胺酶抑制剂、谷氨酰胺类似物或其前药,在肿瘤微环境特异性刺激下控制释放,直接切断肿瘤细胞的能量与合成代谢来源。此外,将谷氨酰胺代谢干预与葡萄糖代谢抑制相结合,即“双重饥饿疗法”,可有效阻断肿瘤细胞的代谢补偿途径,诱导更强烈的代谢应激与细胞死亡。
在克服传统治疗阻力方面,纳米策略亦表现突出。通过协同递送谷氨酰胺代谢抑制剂与化疗药物,可降低肿瘤细胞内谷胱甘肽水平,逆转由抗氧化增强导致的化疗耐药。同时,抑制谷氨酰胺代谢能削弱肿瘤的抗氧化防御体系,显著增强基于活性氧的动力学疗法(如光动力、声动力、化学动力疗法)的杀伤效果。其机制在于阻断谷氨酰胺代谢不仅减少了谷胱甘肽的合成,还通过影响NADPH等辅因子的生成,使肿瘤细胞更易遭受氧化损伤。
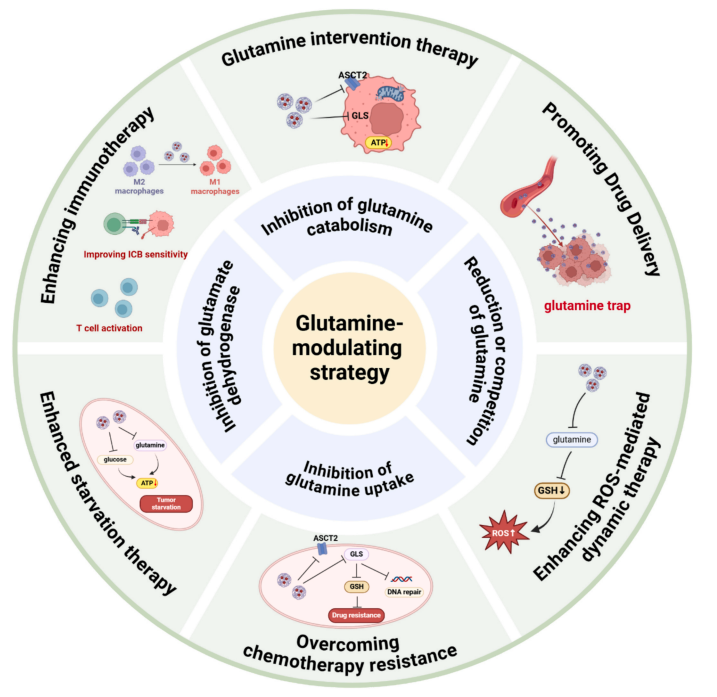
尤为引人注目的是,纳米药物在调节肿瘤免疫微环境方面展现出巨大潜力。肿瘤细胞对谷氨酰胺的激烈竞争会导致肿瘤微环境中免疫细胞(如T细胞)的谷氨酰胺匮乏,从而削弱其抗肿瘤功能。纳米载体可精准递送代谢调节剂至肿瘤部位,在抑制肿瘤细胞谷氨酰胺代谢的同时,改善免疫细胞的代谢状态,促进其活化与增殖。此外,这种代谢重编程可诱导免疫原性细胞死亡,增强抗原呈递,并协同免疫检查点抑制剂,重塑免疫抑制性微环境,从而系统性地激活抗肿瘤免疫应答。
尽管前景广阔,谷氨酰胺调控纳米药物的临床转化仍面临若干关键挑战。这包括对谷氨酰胺代谢网络机制的更深入理解、针对不同肿瘤代谢异质性的个性化设计、多功能纳米药物的理性构建与安全性评估,以及如何平衡治疗效能与生物相容性。未来,通过融合材料科学、纳米技术、计算生物学及临床医学的多学科交叉创新,特别是在智能响应型递送系统、靶向蛋白降解技术及人工智能辅助设计等方向的突破,有望推动该类纳米药物从基础研究走向临床实践,最终为肿瘤治疗提供更为精准、高效且安全的创新解决方案。
参考消息:
DOI: 10.1016/j.mattod.2025.09.019
- 上一款: Advanced Materials | 自
- 下一款: ACS Nano | 多功能基于二硒化物的抗

 学术前沿
学术前沿